Voir la vidéo
- Regardez la vidéo sur youtube
Voir aussi : types de bacon et santé
Généralité
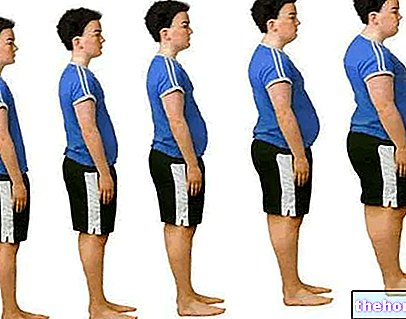
La graisse viscérale - également appelée graisse abdominale - est la partie du tissu adipeux concentrée dans la cavité abdominale et répartie entre les organes internes et le tronc.
La graisse viscérale diffère de la graisse sous-cutanée - concentrée dans l'hypoderme (la couche la plus profonde de la peau) - et de la graisse intramusculaire, qui est plutôt répartie entre les fibres musculaires (cette dernière semble également être significativement corrélée à la résistance à l'insuline).
Obésité abdominale
L'« excès de graisse abdominale est défini par les termes « obésité centrale », « obésité abdominale » et « obésité androïde ». Avec ce dernier terme nous voulons souligner l'association typique de la graisse viscérale avec le sexe masculin et ses hormones (appelées précisément androgènes).
La nécessité de différencier cette forme d'obésité de celle gynoïde - typique du sexe féminin et caractérisée par des accumulations adipeuses concentrées dans la moitié inférieure de l'abdomen, dans les régions fessières et fémorales - découle de l'influence différente des deux phénotypes sur le risque cardiovasculaire, il s'agit donc d'une simple différenciation topographique, mais plutôt d'une distinction à grande signification physiopathologique.

Dangers pour la santé
Des deux types d'obésité, l'obésité abdominale s'est clairement avérée la plus dangereuse, à tel point qu'elle est considérée comme l'un des facteurs de risque les plus importants de morbidité et de mortalité par maladie cardiovasculaire, ainsi que l'un des principaux facteurs de risque de type II. Diabète. L'accumulation exagérée de graisse centrale est également associée aux complications métaboliques et cardiovasculaires typiques du syndrome métabolique (hypertension, hyperlipidémie, stéatose hépatique, athérosclérose et diabète de type II susmentionné).
Les preuves épidémiologiques de la dangerosité de la graisse viscérale ont été confirmées plus récemment, grâce à la multiplication des études sur la fonction endocrinienne du tissu, ou plutôt de l'organe adipeux. a des caractéristiques différentes de la sous-cutanée, à la fois sous le profil cellulaire et sous l'aspect des effets que ces cellules ont sur l'équilibre endocrino-métabolique de l'organisme. En effet, il a été montré que les adipocytes blancs de la graisse viscérale sont particulièrement actifs dans la libération des adipokines, substances à effet local (paracrine), central et périphérique (endocrinien).Par la libération directe ou indirecte de ces substances, la graisse viscérale contrôle « l'équilibre de l'appétit et de l'énergie, l'immunité, l'angiogenèse, la sensibilité à l'insuline et le métabolisme des lipides ».
L'une des adipokines les plus connues, l'adiponectine, améliore la sensibilité à l'insuline et possède une activité anti-inflammatoire ; ses taux, contrairement à ceux de nombreuses autres adipokines, sont plus faibles chez les obèses que chez les personnes de poids normal. D'autre part, l'excès de graisse viscérale augmente la libération de substances telles que l'interleukine 6 (IL-6), la résistine et le TNF-α (cytokines à activité pro-inflammatoire), le PAI-1 (effet pro-thrombotique) et le ASP (activité stimulante sur la synthèse des triglycérides et inhibitrice sur l'oxydation des acides gras).
L'augmentation volumétrique excessive des adipocytes, provoquée par l'accumulation visible de triglycérides, détermine leur mort et la lyse consécutive par les macrophages, qui attaquent les vacuoles lipidiques avec une nouvelle augmentation de l'état inflammatoire de l'organisme (les niveaux de protéine C ont également (réactive, actuellement considérée comme un facteur de risque cardiovasculaire important).
Le nombre de macrophages présents dans le tissu adipeux est proportionnel au degré d'obésité, ou plutôt à l'hypertrophie des adipocytes typiquement associée à l'obésité. Il y a donc une sorte de réaction à corps étranger, avec pour conséquence une inflammation chronique qui, si elle se perpétue dans le temps, prédispose à d'importantes maladies métaboliques.
La réduction de la synthèse et de la libération de monoxyde d'azote, un gaz à l'action vasodilatatrice puissante, contribue à augmenter encore le risque athéroscléreux. Ce gaz favorise la lipolyse et stimule la prolifération des cellules adipeuses brunes, qui, contrairement aux blanches, n'accumulent pas de lipides mais les brûlent, soit pour maintenir la température corporelle dans des environnements froids, soit pour se débarrasser des excès alimentaires qui altéreraient l'« équilibre métabolique. La synthèse du monoxyde d'azote, également active dans l'angiogenèse et dans la mitochondrie locale (qui empêcherait probablement la mort des adipocytes susmentionnée due à l'hypoxie due à une accumulation excessive de lipides), est inhibée par le TNF-α, une adipokine libérée en grande quantité. quantités provenant du tissu adipeux blanc viscéral hypertrophique et des macrophages qui l'attaquent.
La localisation anatomique particulière de la graisse viscérale garantit que les adipokines et autres substances libérées s'écoulent directement dans le système veineux porte, qui les transporte vers le foie. Le rôle métabolique prédominant joué par cette glande permet d'expliquer la grande influence de la graisse viscérale sur la santé de tout l'organisme.
Une caractéristique typique de la graisse viscérale est la plus grande sensibilité aux stimuli lipolytiques, puisque l'action de la lipoprotéine lipase omentale est 50 % supérieure à celle de la graisse sous-cutanée. Cela signifie qu'en cas de perte de poids, la première graisse à "brûler" est juste le viscéral.
L'excès de graisse abdominale est directement lié au tour de taille.En particulier, le risque cardiovasculaire devient cliniquement pertinent lorsque les valeurs seuils de 102 cm de circonférence au niveau ombilical chez l'homme et 88 cm chez la femme sont atteintes.
Pour tenter d'expliquer la corrélation entre l'excès de graisse omentale et le diabète de type II, il a été montré que le flux élevé d'acides gras, provenant des adipocytes viscéraux et allant vers le foie, augmente la production de VLDL (qui, comme on le sait, peut être transformé par la suite en le dangereux LDL - mauvais cholestérol, qui prédispose au processus athéromateux). Il favorise également la néoglucogenèse et réduit la clairance hépatique de l'insuline, avec pour conséquence une augmentation des niveaux de cette hormone dans la circulation. En plus des acides gras à partir des dépôts adipeux viscéraux, il faut aussi et en tout cas tenir compte de l'action des adipokines elles-mêmes. L'interleukine-6, par exemple, dans le foie stimule la néoglucogenèse et la sécrétion de triglycérides, avec une hyperinsulinémie compensatrice.
La forte présence d'acides gras libres dans la circulation amène ces nutriments à « concurrencer » le glucose pour l'entrée dans les cellules, en particulier dans les cellules musculaires. En conséquence, une augmentation de la glycémie se produit, en réponse à laquelle le pancréas augmente la libération d'insuline. La double contribution hépato-pancréatique à l'hyperinsulinémie signifie que malgré les valeurs glycémiques élevées, de grandes quantités d'insuline sont présentes dans la circulation ; dans ces cas, on parle d'insulinorésistance, c'est-à-dire une condition caractérisée par une réponse biologique réduite des tissus à "action de l'insuline. Sans surprise, l'ablation chirurgicale du tissu adipeux viscéral chez les rats modérément obèses est capable de normaliser la résistance à l'insuline.
L'insulinorésistance et l'hyperinsulinémie sont responsables de toutes les altérations du métabolisme du glucose allant de l'altération de la glycémie à jeun à l'altération de la tolérance au glucose et au diabète manifeste. par rapport au poids normal.



-contro-lobesit.jpg)