Qu'est-ce qu'Otezla - apremilast et dans quel cas est-il utilisé ?
Otezla est un médicament utilisé pour traiter les adultes présentant :
- psoriasis en plaques modéré à sévère (une maladie provoquant des plaques rouges squameuses sur la peau). Il est utilisé chez les patients qui n'ont pas répondu ou ne peuvent pas utiliser d'autres traitements systémiques (corps entier) du psoriasis, tels que la cyclosporine, le méthotrexate ou les ultraviolets de type A (PUVA). contenant une substance appelée "psoralène" et est ensuite exposé à la lumière ultraviolette;
- rhumatisme psoriasique actif (inflammation des articulations associée au psoriasis) chez les patients qui ne peuvent pas prendre ou qui ont eu une réponse inadéquate à d'autres traitements par des médicaments appelés antirhumatismaux de fond (ARMM). Otezla peut être pris seul ou en association avec d'autres traitements de fond.
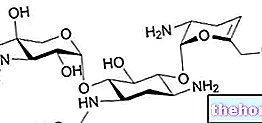
Otezla contient le principe actif aprémilast.
Comment Otezla est-il utilisé - apremilast ?
Otezla n'est délivré que sur ordonnance et le traitement ne doit être instauré que par des spécialistes expérimentés dans le diagnostic et le traitement du psoriasis ou du rhumatisme psoriasique.Le médicament est disponible sous forme de comprimés (10, 20 et 30 mg).Le traitement commence avec une dose de 10 mg le jour 1, qui est progressivement augmentée sur une semaine jusqu'à la dose recommandée de 30 mg deux fois par jour. Les patients présentant une insuffisance rénale sévère doivent recevoir des doses plus faibles. La réponse au traitement doit être évaluée à intervalles réguliers et l'utilisation d'Otezla doit être reconsidérée s'il n'y a pas d'amélioration après six mois.Pour plus d'informations, voir la notice.
Comment fonctionne Otezla - aprémilast ?
Le principe actif d'Otezla, l'aprémilast, bloque l'action d'une enzyme dans les cellules appelée phosphodiestérase 4 (PDE4). Cette enzyme est impliquée dans l'activation de la production de molécules messagères dans le système immunitaire (les défenses naturelles de l'organisme), appelées cytokines et responsables de l'inflammation et d'autres processus à l'origine du psoriasis et du rhumatisme psoriasique. En bloquant la PDE4, l'aprémilast réduit le niveau de ces cytokines dans le corps, réduisant ainsi l'inflammation et les autres symptômes du psoriasis et du rhumatisme psoriasique.
Quel bénéfice Otezla - apremilast a-t-il montré au cours des études ?
Dans le psoriasis, Otezla a fait l'objet de deux études principales portant sur un total de 1 257 patients atteints de psoriasis en plaques modéré à sévère, dans lesquelles le traitement par Otezla a été comparé à un placebo (un traitement fictif). Le principal critère d'évaluation de l'efficacité dans les deux études était la proportion de patients ayant « répondu » au traitement après 16 semaines. 75) Parmi les patients traités par Otezla dans ces deux études, 33 % (168 sur 562) et 29 % (79 sur 274) ont répondu au traitement, contre 5 % (15 sur 274).282) et 6 % (8 sur 137) des personnes traitées par placebo. Pour le rhumatisme psoriasique, Otezla a été comparé à un placebo dans trois études principales, portant sur 1 493 patients atteints d'une maladie active malgré un traitement antérieur. Les patients prenant déjà d'autres DMARD dits « de bas poids moléculaire », tels que le méthotrexate, ont poursuivi ce traitement pendant l'étude. Le principal critère d'évaluation de l'efficacité était une amélioration de 20 % d'un score mesurant les symptômes tels que les articulations enflées et douloureuses (ACR-20) après 16 semaines de traitement. Cette amélioration a été obtenue chez 32 à 41 % des patients traités avec la dose approuvée d'Otezla dans les trois études, contre 18 à 19 % de ceux qui ont reçu le placebo. Le bénéfice a été observé chez les patients traités par Otezla seul et chez ceux qui prenaient également d'autres DMARD. Pour le psoriasis et le rhumatisme psoriasique, le maintien du bénéfice a été démontré avec l'extension du traitement (à 32 et 52 semaines, respectivement).
Quel est le risque associé à Otezla - apremilast ?
Les effets indésirables les plus fréquents avec Otezla (pouvant affecter plus d'1 personne sur 10) sont des effets affectant le système digestif, tels que la diarrhée et les nausées (envie de vomir).Ces effets surviennent généralement au cours des deux premières semaines de traitement et s'améliorent dans les quatre semaines. semaines. D'autres effets indésirables fréquents (pouvant affecter jusqu'à 1 personne sur 10) sont les infections des voies respiratoires supérieures (rhumes) et les céphalées de tension ou céphalées. Otezla ne doit pas être utilisé pendant la grossesse et les femmes en âge de procréer doivent utiliser une contraception efficace pendant Pour la liste complète des effets indésirables rapportés et des limitations rapportées avec Otezla, voir la notice.
Pourquoi Otezla - apremilast a-t-il été approuvé ?
Le comité des médicaments à usage humain (CHMP) de l'Agence a estimé que les bénéfices d'Otezla sont supérieurs à ses risques et a recommandé qu'il soit approuvé pour une utilisation dans l'UE. Le CHMP a considéré que le bénéfice dans le psoriasis et dans le psoriasis était démontré. . Bien que le médicament n'ait pas été comparé à d'autres traitements autorisés, et pour le rhumatisme psoriasique, il n'existe aucune preuve radiologique d'un effet sur la progression de la maladie, la plupart du temps des effets secondaires légers ou modérés et le fait que le médicament puisse être pris par voie orale pourrait le rendre plus acceptable. aux patients, et le comité l'a jugé utile comme traitement de deuxième intention chez les patients ne répondant pas ou incapables d'utiliser les traitements de première intention.
Quelles mesures sont prises pour garantir l'utilisation sûre et efficace d'Otezla - apremilast ?
Un plan de gestion des risques a été élaboré pour garantir qu'Otezla est utilisé de la manière la plus sûre possible.Sur la base de ce plan, des informations de sécurité ont été ajoutées au résumé des caractéristiques du produit et à la notice d'Otezla, y compris les précautions appropriées à suivre par les professionnels de santé et les patients. De plus amples informations sont disponibles dans le résumé du plan de gestion des risques.
Plus d'informations sur Otezla - apremilast
Le 15 janvier 2015, la Commission européenne a délivré une « autorisation de mise sur le marché » pour Otezla, valable dans toute l'Union européenne. Pour la version complète de l'EPAR et le résumé du plan de gestion des risques d'Otezla, veuillez visiter le site Web de l'Agence : ema.Europa. eu/Trouver un médicament / Médicaments à usage humain / Rapports publics européens d'évaluation Pour plus d'informations sur le traitement par Otezla, veuillez lire la notice (incluse dans l'EPAR) ou contacter votre médecin ou votre pharmacien. Dernière mise à jour de ce résumé : 01-2015
Les informations sur Otezla - apremilast publiées sur cette page peuvent être obsolètes ou incomplètes. Pour une utilisation correcte de ces informations, consultez la page Avis de non-responsabilité et informations utiles.