Qu'est-ce que Tasigna ?
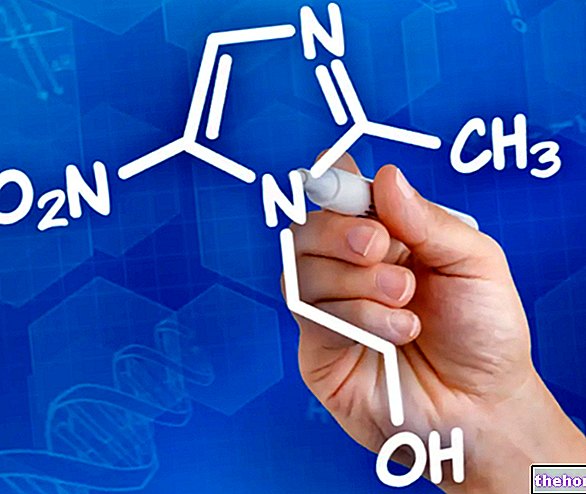
Tasigna est un médicament qui contient le principe actif nilotinib. Le médicament est disponible en gélules jaune clair (200 mg).
A quoi sert Tasigna ?
Tasigna est utilisé pour traiter les adultes atteints de leucémie myéloïde chronique (LMC), un type de cancer des globules blancs dans lequel les granulocytes (une classe de globules blancs) commencent à se développer de manière incontrôlée. Il est utilisé lorsque le patient est « chromosome de Philadelphie positif » (Ph +), ce qui signifie que certains des gènes du patient se sont réorganisés pour former un chromosome spécial, appelé chromosome de Philadelphie. Ce chromosome produit une enzyme qui conduit au développement de la leucémie.
Tasigna est utilisé dans la phase "chronique" et "accélérée" de la LMC. Aucune information n'est disponible sur l'efficacité chez les patients dont la maladie est en « crise blastique » (une autre phase de la LMC).
Tasigna est utilisé chez les patients intolérants ou résistants à d'autres traitements, y compris ceux avec l'imatinib (un autre médicament anticancéreux), ou lorsque leur maladie ne répond pas à ces traitements.
Étant donné que le nombre de patients atteints de LMC est faible, la maladie est considérée comme « rare » et Tasigna a été désigné « médicament orphelin » (un médicament utilisé dans les maladies rares) le 22 mai 2006.
Le médicament ne peut être obtenu que sur ordonnance.
Comment Tasigna est-il utilisé ?
Le traitement par Tasigna doit être initié par un médecin expérimenté dans le diagnostic et le traitement de la leucémie myéloïde chronique. La dose recommandée est de deux gélules deux fois par jour, tant que le patient rapporte un bénéfice. La dose doit être réduite ou le traitement interrompu si le patient présente certains effets secondaires affectant le sang.
Les deux doses doivent être prises avec environ 12 heures de mise au rebut. Les gélules sont avalées entières à l'aide d'un verre d'eau, à jeun pendant deux heures avant et une heure après chaque prise. Si nécessaire, Tasigna peut être administré avec certains autres médicaments. Il doit être utilisé avec prudence chez les patients atteints de problèmes hépatiques ou cardiaques Veuillez vous référer au Résumé des Caractéristiques du Produit (également inclus dans l'EPAR) pour plus de détails.
Comment fonctionne Tasigna ?
Le nilotinib, le principe actif de Tasigna, appartient à une classe de médicaments appelés inhibiteurs de protéine kinase. Ces composés agissent en inhibant une classe d'enzymes appelées
protéine kinase. Le nilotinib agit en bloquant la protéine kinase appelée « BCR-ABL » kinase. Cette enzyme est produite par les cellules leucémiques, ce qui les fait proliférer de manière incontrôlable. En bloquant la kinase Bcr-Abl, Tasigna aide à contrôler l'expansion des cellules leucémiques.
Comment Tasigna a-t-elle été étudiée ?
Les effets de Tasigna ont d'abord été testés dans des modèles expérimentaux avant d'être étudiés chez l'homme.
L'efficacité de Tasigna a été étudiée dans deux études principales portant sur un total de 439 patients atteints de LMC qui ne pouvaient pas tolérer l'imatib ou dont la maladie n'a pas répondu au traitement par ce médicament. Tasigna n'a été comparé à aucun autre traitement.
La première étude a inclus un total de 320 patients dont la maladie était en « phase chronique », dont les trois quarts ne répondaient plus à l'imatinib. Le principal critère d'évaluation de l'efficacité était le pourcentage de patients qui avaient eu une « réponse cytogénétique importante » (le pourcentage de globules blancs des patients qui contenaient le chromosome Philadelphie était tombé à moins de 35 %). La deuxième étude a inclus un total de 119 patients dont la maladie était en « phase accélérée », dont les quatre cinquièmes ne répondaient plus à l'imatinib. Son principal critère d'évaluation de l'efficacité était le pourcentage de patients ayant eu une « réponse hématologique » (un retour à la normale du pourcentage de globules blancs).
Quel bénéfice Tasigna a-t-il démontré au cours des études ?
Dans l'étude de phase chronique sur la LMC, 156 (49 %) des 320 patients ont présenté une réponse cytogénétique significative après avoir pris Tasigna pendant une moyenne de 341 jours (environ onze mois). Dans l'étude de phase accélérée sur la LMC, 50 (42 %) des 119 patients ont présenté une réponse hématologique significative après avoir pris Tasigna pendant 202 jours en moyenne (environ sept mois). Dans les deux études, Tasigna a eu un effet similaire chez les patients qui ne pouvaient pas tolérer l'imatinib et ceux dont la maladie n'y répondait plus.
Quel est le risque associé à Tasigna ?
Les effets indésirables les plus fréquemment provoqués par Tasigna (chez plus de 1 patient sur 10) sont la thrombocytopénie (faible nombre de plaquettes), la neutropénie (faible nombre de globules blancs), l'anémie (faible nombre de globules rouges) , maux de tête, nausées, constipation, diarrhée, éruption cutanée, démangeaisons, fatigue (fatigue) et augmentation des taux de lipase dans le sang (une enzyme produite par le pancréas). Pour la liste complète des effets indésirables rapportés avec Tasigna, voir la notice.
Tasigna ne doit pas être utilisé par des personnes pouvant présenter une hypersensibilité (allergie) au nilotilib ou à l'un des autres composants (composants).
Pourquoi Tasigna a-t-il été approuvé ?
Le comité des médicaments à usage humain (CHMP) conclut que, bien qu'il n'ait été comparé à aucun autre traitement, l'efficacité de Tasigna a été suffisamment démontrée et était comparable à celle d'autres médicaments de la même classe. de Tasigna sont supérieurs aux risques pour le traitement des adultes en phase chronique et accélérée de la LMC à chromosome Philadelphie positif présentant une résistance ou une intolérance à un traitement antérieur, y compris l'imatinib.
Quelles mesures sont prises pour garantir une utilisation sûre de Tasigna ?
La société qui fabrique Tasigna fournira un dossier d'information dans chaque État membre aux médecins et pharmaciens qui prescrivent ou distribuent le médicament.Ce pack leur rappellera comment utiliser Tasigna en toute sécurité chez les patients.
En savoir plus sur Tasigna
Le 19 novembre 2007, la Commission européenne a accordé à Novartis Europharm Limited une « autorisation de mise sur le marché » pour Tasigna, valable dans toute l'Union européenne.
Pour le résumé de l'avis du comité des médicaments orphelins pour Tasigna, cliquez ici.
La version complète de l'EPAR pour Tasigna est disponible ici.
Dernière mise à jour de ce résumé : 05-2009
Les informations sur Tasigna - nilotinib publiées sur cette page peuvent être obsolètes ou incomplètes. Pour une utilisation correcte de ces informations, consultez la page Avis de non-responsabilité et informations utiles.