Généralité
« Donnez-moi de la fièvre et je guérirai toute maladie » : cette déclaration, attribuée au médecin grec Hippocrate (400 av.
La première preuve documentaire sur l'effet curatif possible des températures élevées dans le traitement des tumeurs remonte à 1866, lorsque le médecin allemand Busch a observé la rémission complète d'un sarcome chez un patient après des accès répétés de forte fièvre.

Aujourd'hui, en raison des bénéfices thérapeutiques potentiels de cette technique, l'hyperthermie est reconnue comme le quatrième pilier de l'oncologie.
Qu'est-ce que l'hyperthermie oncologique?
L'hyperthermie oncologique est un traitement clinique pour le traitement des tumeurs malignes, qui peut être utilisé seul ou plus fréquemment en association avec des traitements de radiothérapie et de chimiothérapie.Actuellement, en effet, cette technique n'est pas tant utilisée comme alternative, mais comme complément à autres traitements anticancéreux, cette association permet d'obtenir un renforcement réciproque de l'efficacité thérapeutique. De plus, l'association avec l'hyperthermie permet de réduire les doses de chimiothérapie et de radiothérapie, avec une réduction significative des effets secondaires liés aux thérapies classiques.
Types d'hyperthermie
L'effet thérapeutique de l'hyperthermie pour le traitement des tumeurs peut être exploité en utilisant différentes approches et technologies.
Formes tumorales qui ont montré une bonne réponse à l'hyperthermie :
- Mélanome et autres formes de cancer de la peau
- Cancer du sein
- Sarcome des tissus mous
- Cancer de la vessie
- Carcinomes de la tête et du cou
- Cancer du col de l'utérus et de l'ovaire
- Cancer de la prostate
- Cancer rectal
- Carcinomes axillaires ou de la paroi thoracique
La température et la durée de l'exposition à la chaleur sont les deux grandeurs fondamentales à calibrer pour obtenir le résultat thérapeutique souhaité. Cependant, outre l'étendue de la température atteinte et le temps d'application de la chaleur, il est très important d'évaluer la source qui génère l'échauffement et son site d'application.Par exemple, micro-ondes, radiofréquences, nanoparticules, des ultrasons, des lasers peuvent être utilisés, etc., placés à l'extérieur ou à l'intérieur du corps.
Toutes ces variables sont choisies par l'oncologue en fonction des caractéristiques des différents cas cliniques.
Résultats
En oncologie, les chances de guérison d'une tumeur maligne dépendent de nombreux facteurs, tels que le type et le stade de la tumeur, sa taille et sa localisation, l'âge et l'état de santé général du patient.
Compte tenu de tout cela, plusieurs études ont montré que l'hyperthermie représente un excellent adjuvant aux techniques classiques de traitement des tumeurs, présentant peu de contre-indications pour les patients.
Pour certains types de tumeurs, en associant radiothérapie (et/ou chimiothérapie) à l'hyperthermie, une augmentation de 30 à 100 % des taux de rémission complète et/ou de survie à 2 et 5 ans a été obtenue, par rapport à l'utilisation de la radiothérapie seule (et / ou chimiothérapie). Pour certains cancers, comme le cancer du rectum, les résultats du traitement se sont révélés encore plus encourageants (jusqu'à + 500 % du taux de survie à cinq ans).
Hyperthermie classique 41-45°C
L'hyperthermie oncologique classique vise à réchauffer les cellules cancéreuses sans endommager les tissus sains environnants.
- Si les températures atteintes sont comprises entre 41-43°C (hyperthermie légère) le but principal est d'augmenter la sensibilité de la tumeur aux traitements de radiothérapie et/ou de chimiothérapie.
- Si les températures atteintes sont comprises entre 43 et 46°C, l'effet direct de la chaleur sur la destruction des cellules cancéreuses devient plus important.
Selon les cas, le traitement d'hyperthermie classique dure en moyenne de 40 à 60 minutes et est répété deux à trois fois par semaine. Des traitements plus fréquents auraient en effet tendance à induire une thermorésistance (ou une thermotolérance si l'on préfère) dans les cellules cancéreuses, les rendant capables de mieux supporter les températures élevées.
Selon les cas, la source de chaleur peut avoir différentes tailles et peut être située à différentes profondeurs, dans différents organes ou parties anatomiques du corps humain. Par exemple, parmi les techniques modernes d'hyperthermie, il existe également la possibilité d'implanter des antennes micro-ondes directement dans l'hypoderme.
Comment ça marche
DOMMAGES DIRECTS AUX CELLULES TUMEURS
L'efficacité de l'hyperthermie oncologique repose sur l'angiogenèse chaotique des tissus tumoraux.Fondamentalement, le microenvironnement tumoral présente presque toujours un échafaudage vasculaire chaotique et désorganisé ; en conséquence, les grandes zones tumorales (en particulier la masse centrale) reçoivent des quantités insuffisantes de sang et d'oxygène. En raison de ces altérations des vaisseaux sanguins, la masse néoplasique est incapable de dissiper la chaleur comme les tissus normaux ; en d'autres termes, les tumeurs ont tendance à souffrir beaucoup plus de chaleur que les tissus sains, car certaines de leurs zones reçoivent peu de sang (qui agit comme un véritable réfrigérant) ; pour la même raison, ces zones souffrent déjà de la rareté de l'oxygène et des nutriments et de l'abondance des déchets (hyperacidification).
La chaleur administrée par l'hyperthermie endommage la membrane plasmique, le squelette cellulaire et le noyau ; si l'étendue et la durée de l'hyperthermie sont suffisantes, ces dommages conduisent directement à la mort de la cellule tumorale. Les dommages directs deviennent importants à des températures > 43°C : les dommages indirects, que nous verrons bientôt, sont plutôt typiques de ce qu'on appelle « l'hyperthermie légère » (42-43°C).
DOMMAGES INDIRECTS : HYPERTHERMIE ADJUVANTE
Notre corps réagit à l'augmentation de la température locale en augmentant le flux sanguin vers la zone touchée. De cette façon, les plus grandes quantités de sang circulant "absorbent" la chaleur, préservant les tissus des dommages thermiques. Cette réponse se produit également au niveau tumoral, ainsi - dans les limites de la désorganisation vasculaire particulière - les cellules tumorales soumises à une légère augmentation de température reçoivent de plus grandes quantités de sang et d'oxygène :
- des médicaments antitumoraux peuvent être présents dans le sang, qui grâce à la vasodilatation induite par l'hyperthermie sont capables d'atteindre plus facilement les zones néoplasiques les moins vascularisées ; l'action de ces médicaments pourrait également être facilitée par des effets cellulaires (augmentation de la perméabilité de la membrane plasmique) et enzymatiques. altérations (dénaturation des protéines) induites par la chaleur.
Lorsque les températures dans la masse tumorale dépassent 43 °C, en revanche, une diminution du flux sanguin tumoral est enregistrée, avec pour conséquence un "piégeage" des molécules de médicament.
Les avantages de l'association hyperthermie-chimiothérapie ont été confirmés par plusieurs études.Les médicaments antitumoraux tels que le Melphalan, la Bléomycine, l'Adriamycine, la Mitomycine C, le Nitrosuree, le Cisplatine sont plus efficaces lorsqu'ils sont administrés pendant l'hyperthermie.A cet égard, cependant, il convient de souligner que tous les médicaments de chimiothérapie connus ne trouvent pas d'amélioration de leur efficacité s'ils sont utilisés dans un environnement hyperthermique. - L'apport accru d'oxygène au tissu tumoral amplifie les effets de la radiothérapie, qui sont principalement basés sur les dommages à l'ADN induits par les espèces réactives de l'oxygène (radicaux libres) générés par les rayonnements. compromission cellulaire liée aux dommages précédemment infligés par l'hyperthermie.
Le complément et le renforcement réciproques de l'action entre l'hyperthermie et la radiothérapie découlent du fait que :- les dommages induits par l'hyperthermie sont plus importants dans les zones à faible vascularisation (qui ne peuvent pas dissiper efficacement la chaleur), comme le noyau central hypoxique du nodule néoplasique ;
- les dommages induits par la radiothérapie sont au contraire plus importants dans les zones à forte vascularisation (plus riches en oxygène), telles que les zones du manteau périphérique du nodule tumoral ;
- les deux traitements exercent leur efficacité dommageable maximale sur la tumeur dans différentes phases du cycle cellulaire, étant également complémentaires dans ce sens.
Le gain thérapeutique maximal semble être obtenu en pratiquant le traitement hyperthermique dans une à deux heures après la séance de radiothérapie. En ce qui concerne la thermochimiothérapie, cependant, les deux traitements peuvent également être effectués simultanément.
L'hyperthermie oncologique peut contribuer à la réduction de la masse tumorale en vue d'une opération d'ablation chirurgicale.Elle présente également des bénéfices en termes d'effet antalgique (réduction de la douleur déclenchée par la compression des tissus par la masse néoplasique).
Autres formes d'hyperthermie
HYPERTHERMIE TOTALE DU CORPS
Comme son nom l'indique, cette forme d'hyperthermie assure le réchauffement de tout l'organisme. Le but, dans ce cas, n'est pas de détruire directement la masse tumorale, mais de déterminer sa rémission indirecte au moyen d'un renforcement du système immunitaire. Quête " Ce dernier, en effet, a une capacité intrinsèque à détruire les cellules cancéreuses, et cette capacité augmente énormément dans des conditions de température corporelle élevée.
Le but de l'hyperthermie corporelle totale est d'induire une fièvre artificielle, simulant une attaque fébrile vers 39-41°C. A cet égard, des chambres thermales ou recouvertes d'eau peuvent être utilisées.
L'utilisation du corps total est le plus souvent confinée au cadre expérimental pour le traitement des métastases diffuses. La technique nécessite une surveillance étroite du patient pour éviter les dommages causés par l'hyperthermie, qui peut également être très grave. Il s'agit également d'un traitement adjuvant, de donc à utiliser en association avec d'autres thérapies anticancéreuses.
HYPERTHERMIE INTERSTIZIALE
Comme on le voit pour la curiethérapie - dans laquelle de petites sources radioactives sont implantées dans le tissu cible - "l'hyperthermie interstitielle implique l'implantation de dispositifs capables de générer une "hyperthermie locale". On utilise à cet égard des antennes qui chauffent grâce à l'apport de micro-ondes.
HYPERTHERMIE INFUSIONNELLE et HYPERTHERMIE PERFUSIONNELLE
L'hyperthermie par perfusion intrapéritonéale est basée sur l'utilisation de lavages péritonéaux avec des solutions médicamenteuses à haute température. Il est utilisé dans les cas de néoplasmes péritonéaux difficiles à traiter, tels que le mésothéliome péritonéal et le cancer de l'estomac. D'autres techniques d'hyperthermie reposent sur le même principe, qui consistent à injecter des solutions thérapeutiques chauffées dans d'autres cavités, telles que la cavité pleurale ou vésicale.
Dans l'hyperthermie de perfusion, la circulation extracorporelle est utilisée, avec chauffage d'une partie du sang et réintroduction de celui-ci avec l'ajout de médicaments chimiothérapeutiques, afin d'obtenir des concentrations élevées de médicament dans le tissu perfusé.
HYPERTHERMIE ABLATIVE
Dans ce cas les températures sont bien plus élevées (50-100°C), mais elles ne sont appliquées que quelques minutes. De telles températures sont capables de produire une nécrose immédiate et totale des tissus traités. La chaleur est générée par l'application d'un courant électrique alternatif à travers des électrodes ou par l'utilisation d'un rayonnement laser ou électromagnétique, appliqué directement sur la masse tumorale (traitement invasif). La principale difficulté réside dans la préservation des tissus sains entourant la tumeur.
Bien que cette technique exploite l'effet thérapeutique de la chaleur, pour le mécanisme d'action, elle va au-delà du concept traditionnel d'hyperthermie.
NOUVEAUX DÉVELOPPEMENTS DANS LE « DOMAINE DE L'HYPERTHERMIE »
La science de l'hyperthermie évolue constamment pour développer des traitements de plus en plus sélectifs afin de détruire les cellules cancéreuses sans endommager les cellules saines.
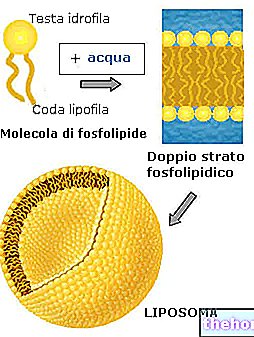
Les développements les plus récents concernent la thermométrie non invasive avec l'utilisation de scanners à résonance magnétique (pour évaluer la température dans les différentes zones tumorales), l'hyperthermie magnéto fluide et l'utilisation de liposomes thermosensibles. Ces derniers sont des médicaments enfermés dans des vésicules lipidiques, stables à des températures corporelles normales mais capables de libérer leur contenu à des températures d'environ 40-43°C ; ces médicaments représentent donc la combinaison idéale avec les traitements régionaux de l'hyperthermie.
Limites
Comprendre les mécanismes d'action de l'hyperthermie et les bénéfices potentiels qui en découlent dans le traitement des tumeurs pourrait conduire à un enthousiasme excessif du lecteur envers ce type de traitement.
Bien qu'elle soit étayée par des preuves suffisantes d'efficacité, l'application de l'hyperthermie en oncologie retient certains problèmes critiques. Tout d'abord, en pratique clinique, il peut y avoir des contre-indications ou des limites qui rendent l'intervention impraticable, certaines techniques par exemple prévoient de véritables interventions chirurgicales plus ou moins invasives, d'autres restent encore majoritairement cantonnées au milieu expérimental. pour dépasser les limites techniques liées à l'émission de chaleur, la profondeur de pénétration, l'homogénéité des champs thermiques et la nécessité d'un dosage thermique correct pour éviter d'endommager les tissus sains. À cet égard, d'autres études et développements technologiques sont souhaitables pour développer des protocoles efficaces et standardisés à adopter dans différentes situations cliniques.











---pan-di-spagna-per-rotolo-dolce.jpg)




