Qu'est-ce que Betmiga - Mirabegron ?
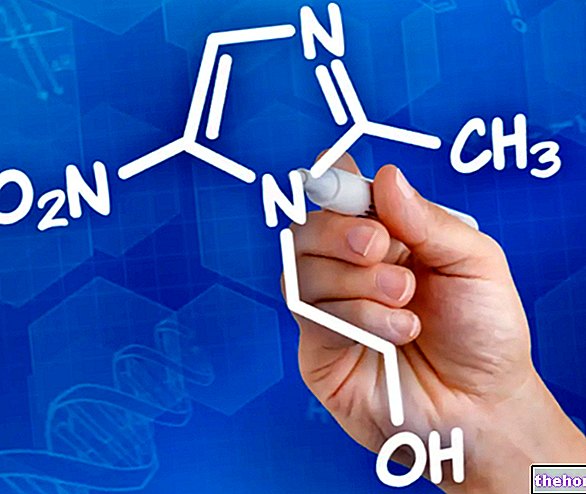
Betmiga est un médicament qui contient le principe actif mirabegron. Il est disponible sous forme de comprimés à libération prolongée (25 mg, 50 mg). Le terme "libération prolongée" signifie que le mirabegron est libéré lentement du comprimé sur une période de plusieurs heures.
A quoi sert Betmiga - Mirabegron ?
Betmiga est utilisé chez les adultes atteints du syndrome de la vessie hyperactive. Il est indiqué dans le traitement de certains symptômes de cette affection : envie d'uriner (besoin d'uriner soudain et urgent), augmentation de la fréquence des mictions (besoin d'uriner fréquemment) et incontinence par impériosité (perte involontaire d'urine de la vessie suite à une miction impérative).
Le médicament ne peut être obtenu que sur ordonnance.
Comment Betmiga - Mirabegron est-il utilisé ?
La dose recommandée de Betmiga est de 50 mg une fois par jour. Chez les patients présentant une insuffisance rénale ou hépatique, le médecin peut prescrire une dose plus faible ou éviter l'utilisation de Betmiga, en particulier si les patients prennent d'autres médicaments.
Pour des informations plus détaillées, voir la notice (également incluse dans l'EPAR).
Comment fonctionne Betmiga - Mirabegron ?
Le principe actif de Betmiga, le mirabegron, est un agoniste des récepteurs bêta-3 adrénergiques. Il agit en liant et en activant les récepteurs bêta-3 présents dans les cellules musculaires de la vessie. Des études expérimentales ont montré qu'une fois activés, les récepteurs bêta-3 provoquent un relâchement des muscles de la vessie. On pense que cela conduit à une augmentation de la capacité de la vessie et induit un changement dans la façon dont la vessie se contracte, avec une réduction conséquente des contractions de la vessie et, par conséquent, un nombre plus limité de mictions indésirables.
Comment Betmiga - Mirabegron a-t-il été étudié ?
Les effets de Betmiga ont d'abord été testés dans des modèles expérimentaux avant d'être étudiés chez l'homme.
Betmiga a fait l'objet de trois études principales portant sur 4 611 patients atteints d'hyperactivité vésicale. Les patients ont été traités par Betmiga (25 mg, 50 mg ou 100 mg) ou un placebo (substance sans effet sur l'organisme) tous les jours pendant 3 mois. Le principal critère d'évaluation de l'efficacité était les modifications de la fréquence des mictions et des épisodes de miction quotidienne. incontinence après 3 mois de traitement.
Quel bénéfice Betmiga - Mirabegron a-t-il montré au cours des études ?
Le traitement par Betmiga 50 mg une fois par jour s'est avéré efficace pour réduire la fréquence des mictions et les épisodes d'incontinence. Après 3 mois de traitement, Betmiga 50 mg a réduit le nombre de mictions quotidiennes de 1,8 en moyenne, tandis que le placebo a induit une réduction de 1,2 par jour.
Betmiga 50 mg a permis de réduire les épisodes d'incontinence quotidiens de 1,5 par rapport au placebo, ce qui a entraîné une réduction de 1,1 de ces événements.
Quel est le risque associé à Betmiga - Mirabegron ?
Les effets indésirables les plus fréquents de Betmiga sont la tachycardie (rythme cardiaque rapide), observée chez un peu plus de 1 patient sur 100, et l'infection des voies urinaires (infection des structures qui transportent l'urine), observée chez un peu moins de 3 patients sur 100. Grave mais les effets secondaires rares incluent la fibrillation auriculaire (rythme cardiaque altéré). Pour la liste complète des effets indésirables rapportés avec Betmiga, voir la notice.
Betmiga ne doit pas être utilisé chez les personnes pouvant présenter une hypersensibilité (allergie) au mirabegron ou à l'un des autres composants.
Pourquoi Betmiga - Mirabegron a-t-il été approuvé ?
Le CHMP a noté que les effets bénéfiques observés avec Betmiga, bien que modestes, sont comparables aux bénéfices d'autres médicaments autorisés pour cette affection. En ce qui concerne la sécurité, les effets indésirables sont pour la plupart comparables aux effets observés avec d'autres médicaments utilisés
dans le traitement du syndrome de la vessie hyperactive. Le risque potentiel d'hypersensibilité (réactions allergiques) et les effets sur le cœur ont été correctement pris en compte dans les informations sur le produit. Le CHMP a donc décidé que les bénéfices de Betmiga sont supérieurs à ses risques et a recommandé qu'il obtienne une « autorisation de mise sur le marché » pour le médicament.
Plus d'informations sur Betmiga - Mirabegron
Le 20 décembre 2012, la Commission européenne a délivré une « autorisation de mise sur le marché », valable dans toute l'Union européenne.
Pour la version complète de l'EPAR pour Betmiga, consulter le site internet de l'Agence : ema.Europa.eu/Find medicine / Human medicine / European public assessment reports. Pour plus d'informations sur le traitement par Betmiga, veuillez lire la notice (incluse dans l'EPAR) ou contacter votre médecin ou votre pharmacien.
Dernière mise à jour de ce résumé : 12/2012.
Les informations sur Betmiga - Mirabegron publiées sur cette page peuvent être obsolètes ou incomplètes. Pour une utilisation correcte de ces informations, consultez la page Avis de non-responsabilité et informations utiles.

-plasmatica---tempo.jpg)