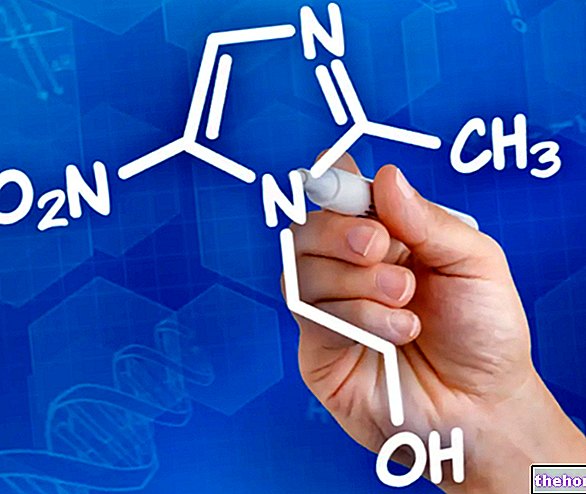
Ingrédients actifs : Céfazoline
CEFAMEZIN 250 mg/2 ml poudre et solvant pour solution injectable pour voie intramusculaire
CEFAMEZIN 500 mg/2 ml poudre et solvant pour solution injectable pour voie intramusculaire
CEFAMEZIN 1000 mg/4 ml poudre et solvant pour solution injectable pour voie intramusculaire
CEFAMEZIN 1000 mg/10 ml poudre et solvant pour solution injectable pour voie intraveineuse
Pourquoi Cefamezin est-il utilisé? Pourquoi est-ce?
Cefamezin contient le principe actif céfazoline. La céfazoline est un antibiotique qui appartient à un groupe de médicaments appelés céphalosporines et qui agit contre les infections pouvant affecter différentes parties du corps. La céfazoline tue les bactéries sensibles responsables des infections.
Cefamezin est utilisé chez l'adulte et l'enfant pour traiter :
- infections des voies respiratoires
- infections des reins, de la vessie, de l'urètre et des organes génitaux
- infections de la femme pendant la grossesse, l'accouchement et après l'accouchement (infections obstétricales) et infections des organes génitaux féminins (infections gynécologiques)
- infections de la peau et des tissus mous (par exemple : muscles, tendons)
- infections des oreilles, du nez et de la gorge
- infections oculaires
- infections gastriques et intestinales
- infections du foie et des voies biliaires
- infections des os et des articulations
- infection de l'appendice (appendicite)
- infection de la paroi interne de l'abdomen et des organes abdominaux (péritonite)
- infection du sang (septicémie)
- infection de la surface interne du cœur (endocardite)
Cefamezin est utilisé chez l'adulte et l'enfant pour prévenir et traiter :
- infections qui peuvent se développer avant, pendant ou après la chirurgie.
Contre-indications Quand Cefamezin ne doit pas être utilisé
N'utilisez pas Céfamézine :
- si vous ou votre enfant êtes allergique à la céfazoline, à d'autres antibiotiques appartenant à la classe des céphalosporines ou à l'un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
Précautions d'emploi Quelles sont les informations à connaître avant de prendre Cefamezin
Adressez-vous à votre médecin, médecin traitant votre enfant, pharmacien ou infirmier/ère avant d'utiliser Cefamezin.
Informez le médecin ou le médecin traitant votre bébé si vous pensez que l'un des cas suivants s'applique à vous ou à votre bébé :
- vous avez eu une réaction allergique à la pénicilline, aux céphalosporines ou à d'autres antibiotiques similaires. Si vous ou votre enfant avez eu une allergie à ces antibiotiques dans le passé, il est plus probable qu'une nouvelle réaction allergique, même sévère, puisse survenir après l'administration de Cefamezin. Si vous avez une réaction allergique, arrêtez immédiatement le traitement par Cefamezin et contactez votre médecin (voir également rubrique 4 « Effets indésirables éventuels »);
- souffrez de problèmes rénaux (insuffisance rénale) ou êtes en dialyse. Votre médecin contrôlera régulièrement le fonctionnement de vos reins et ajustera la dose de Cafamezin en fonction de votre état.
Adressez-vous à votre médecin, médecin traitant votre enfant, pharmacien ou infirmier/ère si vous ou votre enfant présentez l'une des affections suivantes lors de la prise de Cefamezin (voir également rubrique 4 « Effets indésirables éventuels »):
- nouvelle apparition de diarrhée, qui peut être de type bénigne, mais peut entraîner la mort dans certains cas (colite mortelle). La diarrhée peut survenir avec l'utilisation de presque tous les antibiotiques, y compris Cefamezin, et est due à l'altération de la flore bactérienne normale de l'intestin qui permet la prolifération d'une bactérie appelée Clostridium difficile.En cas de diarrhée, le médecin vous soumettra ou votre enfant à des contrôles minutieux ;
- apparition d'infections causées par des micro-organismes résistants à la céfamézine.
Interactions Quels médicaments ou aliments peuvent modifier l'effet de Cefamezin
Informez votre médecin, votre médecin traitant votre enfant, votre pharmacien ou votre infirmier/ère si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Informez votre médecin, votre médecin traitant votre enfant, votre pharmacien ou votre infirmier/ère si vous ou votre enfant prenez l'un des médicaments suivants :
- warfarine (médicament qui ralentit ou arrête le processus de coagulation du sang). La céfamézine peut augmenter l'action de la warfarine et augmenter le risque de saignement ;
- probénécide (médicament contre la goutte et l'accumulation d'acide urique).L'administration concomitante de ce médicament peut augmenter l'efficacité de Cefamezin.
Tests de laboratoire
La céfamézine peut modifier les résultats de certains tests de laboratoire. Si vous ou votre enfant devez subir des tests de laboratoire (par exemple des analyses de sang ou d'urine), vous devez informer votre médecin de votre traitement par Cefamezin.
Avertissements Il est important de savoir que :
La grossesse et l'allaitement
Si vous êtes enceinte ou si vous allaitez, si vous pensez être enceinte ou prévoyez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant d'utiliser ce médicament.
Si vous êtes enceinte ou si vous allaitez, votre médecin évaluera le rapport bénéfice/risque du traitement par ce médicament.
Conduire et utiliser des machines
On ne sait pas si Cefamezin modifie l'aptitude à conduire des véhicules ou à utiliser des machines.
La céfamézine contient du sodium
Cefamezin 250 mg/2 ml poudre et solvant pour solution injectable pour voie intramusculaire contient moins de 1 mmol (23 mg) de sodium par flacon, c'est-à-dire qu'il est essentiellement « sans sodium ».
Cefamezin 500 mg/2 ml poudre et solvant pour solution injectable pour voie intramusculaire contient 1,1 mmol (ou 25,3 mg) de sodium par flacon. A prendre en considération chez les personnes dont la fonction rénale est réduite ou qui suivent un régime pauvre en sodium
Cefamezin 1000 mg / 4 ml poudre et solvant pour solution injectable pour voie intramusculaire et Cefamezin 1000 mg / 10 ml poudre et solvant pour solution injectable pour voie intraveineuse contiennent 2,2 mmol (ou 50,6 mg) de sodium par flacon.
A prendre en considération chez les personnes dont la fonction rénale est réduite ou qui suivent un régime pauvre en sodium.
Posologie et mode d'utilisation Comment utiliser Cefamezin : Posologie
Utilisez toujours ce médicament en suivant exactement les indications de votre médecin, médecin traitant votre enfant, pharmacien ou infirmier/ère.
La dose quotidienne recommandée chez l'adulte varie de 1 à 3 grammes, divisée en 2 prises (administrées toutes les 12 heures).
La dose quotidienne recommandée chez les enfants varie de 20 à 50 mg par kg de poids corporel, divisée en 2 prises (administrées toutes les 12 heures).
Infections graves
La dose quotidienne recommandée chez l'adulte varie de 4 à 12 grammes, divisée en 3 prises (administrées toutes les 8 heures).
La dose quotidienne recommandée est de 100 mg par kg de poids corporel, divisée en 3 prises (administrées toutes les 8 heures).
Si vous/votre enfant avez des problèmes rénaux
Si vous ou votre enfant avez des problèmes rénaux (insuffisance rénale), votre médecin vous prescrira des doses plus faibles de Cefamezin et des doses moins fréquentes que la normale.
Mode d'administration
La céfamézine peut être administrée par voie intramusculaire ou intraveineuse.
Injection intramusculaire
Cefamezin 250 mg/2 ml poudre et solvant pour solution injectable, Cefamezin 500 mg/2 ml poudre et solvant pour solution injectable et Cefamezin 1000 mg/4 ml poudre et solvant pour solution injectable ne peuvent être administrés que par injection dans un muscle (intramusculaire). Le flacon de solvant inclus dans l'emballage contient de la lidocaïne, un anesthésique local, pour soulager la douleur pendant l'injection.
Retirer le liquide du flacon de solvant avec une seringue et l'injecter dans le flacon contenant la poudre.
Bien agiter le flacon jusqu'à ce que la poudre soit complètement dissoute. Injectez Cefamezin profondément dans l'épaisseur d'une fesse ou d'une zone antérieure de la cuisse.
Si vous êtes traité avec un autre antibiotique intramusculaire, n'administrez pas Cefamezin dans la même seringue.
Injection intraveineuse
Cefamézine 1000 mg/10 ml poudre et solvant pour solution injectable ne doit être administré que par injection dans une veine (voie intraveineuse).
Reconstituer la poudre avec le solvant contenu dans le flacon inclus dans la boîte ou avec toute autre solution compatible (voir rubrique « Les informations suivantes sont destinées uniquement aux professionnels de santé »).
Laisser reposer jusqu'à dissolution complète.
La céfamézine peut être administrée lentement dans une veine (perfusion de 10 ml sur environ 3 à 5 minutes) de manière continue ou intermittente.
Instructions pour l'ouverture du flacon
Pour ouvrir, tenir le flacon verticalement, en s'assurant que le pointe colorée est dans la position indiquée sur la figure
Repoussez le haut du flacon comme indiqué sur la figure
Surdosage Que faire si vous avez pris trop de Cefamezin
Si vous ou votre enfant recevez plus de Cefamezin qu'ils n'auraient dû
Il est important que vous ou votre enfant n'utilisiez jamais plus de médicament que prescrit. Cependant, il n'y a actuellement aucun effet secondaire connu causé par des doses excessives de Cefamezin.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin, au médecin traitant votre enfant ou au pharmacien.
Effets secondaires Quels sont les effets secondaires de Cefamezin
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, bien que tout le monde n'y soit pas sujet.
ARRÊTEZ immédiatement d'utiliser Cefamezin si vous ou votre enfant ressentez l'un des effets secondaires suivants, car ils peuvent être graves :
- réaction allergique sévère (choc anaphylactique) (voir rubrique 2 « Avertissements et précautions »)
- gonflement du visage, de la langue et de la gorge entraînant une incapacité à avaler et à respirer (œdème de Quincke)
- inflammation sévère de la dernière partie de l'intestin appelée côlon (colite) causée par la prolifération d'une bactérie appelée Clostridium difficile (colite pseudomembraneuse) (voir rubrique 2 « Avertissements et précautions »)
- mort (nécrose) et desquamation de zones de la peau et des muqueuses de la bouche, des yeux et de l'urètre (syndrome de Stevens-Johnson)
- anémie due à une destruction excessive des globules rouges (anémie hémolytique).
Parlez à votre médecin si vous ou votre enfant ressentez l'un des effets secondaires suivants :
Infections
- infections vaginales à Candida (un champignon)
- infections par des bactéries non sensibles à la céfamézine
Effets affectant le sang et la moelle osseuse
- augmentation du nombre d'un type de globules blancs appelés « éosinophiles » (éosinophilie) dans le sang
- réduction du nombre d'un type de globules blancs appelés « neutrophiles » dans le sang (neutropénie)
- réduction du nombre de tous les types de globules blancs dans le sang (leucopénie)
Effets affectant l'oreille et l'équilibre
- vertige
Effets affectant le cœur
- sensation d'essoufflement ou de douleur thoracique (oppression thoracique)
Effets affectant les vaisseaux sanguins
- pression artérielle basse (hypotension)
Effets affectant l'estomac et les intestins
- inflammation de la langue (glossite)
- la nausée
- il vomit
- la diarrhée
- brûlures d'estomac
- douleur dans l'abdomen
Effets affectant la peau
- éruption
- urticaire
- éruption cutanée avec formation de petites bosses et de taches rougeâtres (éruptions maculopapuleuses)
- rougeur de la peau
- démanger
Effets affectant les muscles et les os
- douleurs articulaires (arthralgie)
Modification des examens médicaux
- augmentation dans le sang de certaines substances normalement produites par le foie (alanine aminotransférase, aspartate aminotransférase, bilirubine, azote)
Déclaration des effets secondaires
Si vous ou votre enfant ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien, y compris tout effet indésirable possible non mentionné dans cette notice. Vous pouvez également signaler les effets secondaires directement via le système national de déclaration à l'adresse : https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
En signalant les effets secondaires, vous pouvez contribuer à fournir plus d'informations sur la sécurité de ce médicament.
Expiration et conservation
Gardez ce médicament hors de la vue et de la portée des enfants.
N'utilisez pas ce médicament après la date de péremption indiquée sur la boîte, le flacon et l'ampoule après « EXP ». La date d'expiration fait référence au dernier jour de ce mois.
Conserver dans l'emballage d'origine.
Après préparation, la solution est stable pendant 24 heures à température ambiante et pendant 96 heures lorsqu'elle est conservée au réfrigérateur (5°C).
Dans les solutions préparées, un dépôt cristallin peut se former. Pour récupérer la solution claire, chauffez le flacon dans votre main ou dans de l'eau tiède.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères.Demandez à votre pharmacien comment jeter les médicaments que vous n'utilisez plus.Cela contribuera à protéger l'environnement.
Ce que contient Céfamézine
L'ingrédient actif est la céfazoline (sous forme de céfazoline sodique).
Céfamézine 250 mg/2 ml poudre et solvant pour solution injectable pour voie intramusculaire
Chaque flacon de poudre contient 262 mg de céfazoline sodique (correspondant à 250 mg de céfazoline).
Le flacon de solvant contient du chlorhydrate de lidocaïne et de l'eau pour préparations injectables.
Céfamézine 500 mg/2 ml poudre et solvant pour solution injectable pour voie intramusculaire
Chaque flacon de poudre contient 524 mg de céfazoline sodique (correspondant à 500 mg de céfazoline).
Le flacon de solvant contient du chlorhydrate de lidocaïne et de l'eau pour préparations injectables.
Céfamézine 1000 mg/4 ml poudre et solvant pour solution injectable pour voie intramusculaire
Chaque flacon de poudre contient 1048 mg de céfazoline sodique (correspondant à 1000 mg de céfazoline).
Le flacon de solvant contient du chlorhydrate de lidocaïne et de l'eau pour préparations injectables.
Céfamézine 1000 mg/10 ml poudre et solvant pour solution injectable pour voie intraveineuse
Chaque flacon de poudre contient 1048 mg de céfazoline sodique (correspondant à 1000 mg de céfazoline).
Le flacon de solvant contient de l'eau pour préparations injectables.
Qu'est-ce que Cefamezin et contenu de l'emballage extérieur
Après reconstitution, la solution est limpide, d'aspect incolore à jaune pâle.
Céfamézine 250 mg/2 ml poudre et solvant pour solution injectable pour voie intramusculaire
Chaque boîte contient 1 flacon en verre avec bouchon caoutchouc/aluminium contenant la poudre + 1 flacon en verre contenant 2 ml de solvant.
Céfamézine 500 mg/2 ml poudre et solvant pour solution injectable pour voie intramusculaire
Chaque boîte contient 1 flacon en verre avec bouchon caoutchouc/aluminium contenant la poudre + 1 flacon en verre contenant 2 ml de solvant.
Céfamézine 1000 mg/4 ml poudre et solvant pour solution injectable pour voie intramusculaire
Chaque boîte contient 1 flacon en verre avec bouchon caoutchouc/aluminium contenant la poudre + 1 flacon en verre contenant 4 ml de solvant.
Céfamézine 1000 mg/10 ml poudre et solvant pour solution injectable pour voie intraveineuse
Chaque boîte contient 1 flacon en verre avec bouchon caoutchouc/aluminium contenant la poudre + 1 flacon en verre contenant 10 ml de solvant.
Notice d'emballage source : AIFA (Agence italienne des médicaments). Contenu publié en janvier 2016. Les informations présentes peuvent ne pas être à jour.
Pour avoir accès à la version la plus à jour, il est conseillé d'accéder au site Internet de l'AIFA (Agence Italienne du Médicament). Avis de non-responsabilité et informations utiles.
01.0 DÉNOMINATION DU MÉDICAMENT
CEFAMEZIN POUDRE ET SOLVANT POUR SOLUTION INJECTABLE POUR USAGE INTRAMUSCULAIRE
02.0 COMPOSITION QUALITATIVE ET QUANTITATIVE
CEFAMEZIN 250 mg/2 ml Poudre et solvant pour solution injectable pour voie intramusculaire
Chaque flacon de 250 mg (utilisation IM) contient :
Principe actif: céfazoline sodique 262 mg égal à 250 mg de céfazoline.
CEFAMEZIN 500 mg/2 ml Poudre et solvant pour solution injectable pour voie intramusculaire
Chaque flacon de 500 mg (utilisation IM) contient :
Principe actif: céfazoline sodique 524 mg égal à 500 mg de céfazoline.
CEFAMEZIN 1000 mg/4 ml Poudre et solvant pour solution injectable pour voie intramusculaire
Chaque flacon de 1 g (utilisation IM) contient :
Principe actif: céfazoline sodique 1,048 g égal à 1 g de céfazoline.
CEFAMEZIN 1000 mg/10 ml Poudre et solvant pour solution injectable pour voie intraveineuse
Chaque flacon de 1 g (usage intraveineux) contient :
Principe actif: céfazoline sodique 1,048 g égal à 1 g de céfazoline.
Pour la liste complète des excipients, voir rubrique 6.1
03.0 FORME PHARMACEUTIQUE
Poudre et solvant pour injection:
1 flacon de 250 mg + 1 flacon de solvant de 2 ml
1 flacon de 500 mg + 1 flacon de 2 ml de solvant
1 flacon de 1000 mg + 1 flacon de solvant de 4 ml
UTILISATION INTRAMUSCULAIRE
1 flacon de 1000 mg + 1 flacon de 10 ml de solvant
UTILISATION INTRAVEINEUSE
04.0 INFORMATIONS CLINIQUES
04.1 Indications thérapeutiques
CEFAMEZIN est indiqué dans le traitement des infections suivantes causées par des micro-organismes sensibles telles que : infections des voies respiratoires, infections génito-urinaires, infections gynéco-obstétricales, infections de la peau et des tissus mous, infections ORL, infections ophtalmologiques, infections gastro-entérologiques, infections hépatobiliaires, infections ostéoarticulaires, appendicite, péritonite, septicémie, endocardite.
Il est également indiqué pour la prophylaxie et le traitement des infections chirurgicales.
04.2 Posologie et mode d'administration
Adultes et enfants
La posologie de CEFAMEZIN est de 1-3 g/jour chez l'adulte et de 20-50 mg/kg/jour chez l'enfant.
Chez les patients insuffisants rénaux, les doses doivent être ajustées en fonction du degré d'insuffisance (voir le tableau suivant).
CEFAMEZIN est habituellement administré toutes les 12 heures; dans les cas graves, il est préférable de diviser la dose quotidienne en 3 prises. Dans le traitement des infections particulièrement graves, CEFAMEZIN a été utilisé à la dose de 4 à 12 g/jour chez l'adulte et de 100 mg/kg/jour chez l'enfant.
Mode d'administration
CEFAMEZIN peut être administré par voie intramusculaire et intraveineuse.
Administration intramusculaire: dissoudre le contenu d'une bouteille avec le solvant joint.
L'ampoule de solvant contenant un anesthésique, jointe aux boîtes de 1 g, 500 mg, 250 mg, doit être utilisée uniquement pour une administration intramusculaire.
Administration intraveineuse: CEFAMEZIN peut être administré par injection intraveineuse directe lente (10 ml de solution en 3 à 5 minutes) en perfusion intraveineuse continue ou intermittente.
Pour l'administration intraveineuse, dissoudre le contenu des flacons dans de l'eau pour préparations injectables ou dans :
eau pour préparations injectables ou en solution glucosée, solution physiologique, dextrose 5% et 10%, dextrose 5% + chlorure de sodium 0,90%, dextrose 5% + chlorure de sodium 0,45%, dextrose 5% + chlorure de sodium 0,20%, dextrose 5% dans Ringer's solution, Ringer's, Ringer lactate, 5% bicarbonate de sodium, 5% ou 10% invertose.
04.3 Contre-indications
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
CEFAMEZIN est contre-indiqué chez les patients allergiques aux céphalosporines.
04.4 Mises en garde spéciales et précautions d'emploi appropriées
Tant au niveau clinique qu'au niveau du laboratoire, il existe des preuves d'une allergénicité croisée partielle entre la pénicilline et les céphalosporines et, bien que rares, des cas de réactions aux deux médicaments ont été rapportés, parfois même de type anaphylactique, en particulier après administration parentérale.
La céfazoline, administrée à titre prophylactique aux patients subissant une chirurgie à cœur ouvert, pourrait avoir un effet additif à la warfarine en produisant une hypoprothrombinémie. La réponse de la prothrombine à la warfarine après la céfazoline était d'intensité intermédiaire par rapport au céfamandal (plus grande hypoprothrombinémie) et à la vancomycine (moins d'hypoprothrombinémie). Bien que le mécanisme exact de ce phénomène ne soit pas entièrement connu, la prudence est recommandée lors de l'administration de warfarine chez les patients recevant de la céfazoline (voir article 4.5).
La tolérance de CEFAMEZIN est bonne, mais la fonctionnalité du rein doit en tout état de cause être vérifiée, notamment en cas d'insuffisance rénale et d'utilisation simultanée de médicaments potentiellement néphrotoxiques.
Chez les patients sous dialyse péritonéale (par exemple dialyse péritonéale continue ambulatoire, ou dialyse péritonéale cyclique continue), la présence de céfazoline dans l'organisme est fortement influencée par le débit du liquide dialysé. L'augmentation de la vitesse du liquide dialysé à des valeurs > 5,50 ml / minute chez les patients sous dialyse péritonéale entraîne une augmentation de l'élimination de la céfazoline de l'organisme.Par conséquent, les doses de médicament doivent être reconsidérées pour éviter les situations de sous-dosage et les échecs thérapeutiques ultérieurs. De plus, chez les patients atteints de péritonite secondaire à une dialyse péritonéale, le débit de dialysat doit être maintenu aux valeurs de l'antibiothérapie à la céfazoline (voir rubrique 5.2).
L'utilisation prolongée d'antibiotiques peut favoriser le développement de micro-organismes non sensibles.
Une prudence particulière dans l'administration de la céfazoline est recommandée chez les patients hospitalisés, en particulier les personnes âgées, car une corrélation directe a été démontrée entre l'utilisation de cet antibiotique et l'apparition d'une diarrhée associée à Clostridium difficile (voir rubrique 4.8).
04.5 Interactions avec d'autres médicaments et autres formes d'interactions
En cas d'association avec un autre antibiotique, il est recommandé de ne pas administrer la céfazoline dans la même seringue ou dans le même récipient de perfusion.
La céfazoline, administrée en association avec la warfarine, pourrait avoir un effet additif avec cette dernière sur l'apparition d'une hypoprothrombinémie. Le mécanisme exact de ce phénomène n'est pas entièrement connu et une prudence particulière est recommandée lors de l'administration concomitante de céfazoline et de warfarine chez les patients nécessitant un traitement anticoagulant (voir rubrique 4.4).
Le probénécide, administré en concomitance avec la céfazoline, réduit l'élimination de cette dernière par un mécanisme compétitif d'excrétion tubulaire rénale (voir rubrique 5.1).
L'administration de céphalosporines peut interférer avec certains tests de laboratoire, provoquant une pseudo-positivité de la glycosurie avec les méthodes de Benedict, Felhing et "Clinitest", mais pas avec les méthodes enzymatiques.
Un test de Coombs positif (parfois faux) a été rapporté pendant le traitement par les céphalosporines.
04.6 Grossesse et allaitement
Chez la femme enceinte et allaitante, le produit doit être administré en cas de besoin réel et sous contrôle médical.
04.7 Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucune donnée n'est connue à ce sujet.
04.8 Effets indésirables
Comme avec les autres céphalosporines, les effets secondaires se limitent généralement à des phénomènes d'hypersensibilité occasionnels. Des cas de choc et de réactions anaphylactiques, de réactions anaphylactoïdes, de réactions d'hypersensibilité médicamenteuse et d'hypotension ont également été rapportés. La possibilité de l'apparition de ce dernier est plus grande chez les personnes ayant déjà eu des réactions d'hypersensibilité et chez celles ayant des antécédents d'allergie, d'asthme, de rhume des foins, d'urticaire.
Les réactions secondaires suivantes ont été rapportées : glossite, nausées, vomissements, éruption cutanée, urticaire, éruption maculopapuleuse, érythème, prurit, éruption médicamenteuse, diarrhée, brûlures d'estomac, douleurs abdominales signalées par certains patients ; très rarement urticaire légère ou éruption cutanée, démangeaisons, arthralgie. De rares cas de syndrome de Stevens-Johnson ont été rapportés. La possibilité rare d'apparition de diarrhée a été rapportée Clostridium difficile (voir rubrique 4.4) et la possibilité encore plus rare d'évolution vers une colite pseudomembraneuse menaçant le pronostic vital. Modifications occasionnellement transitoires de certains paramètres de laboratoire tels que éosinophilie, leucopénie, neutropénie, augmentation des transaminases sériques, de la bilirubine totale et de l'azotémie. D'autres réactions observées ont été des vertiges, une oppression thoracique, une vaginite à Candida également liée au développement de micro-organismes non sensibles. Ces phénomènes collatéraux ont rarement été si intenses qu'elles nécessitent l'arrêt du traitement.
Des cas d'anémie hémolytique ont été rapportés suite à un traitement par les céphalosporines.
04.9 Surdosage
Aucun effet toxique d'un surdosage de céfazoline n'a été rapporté dans la littérature.
05.0 PROPRIÉTÉS PHARMACOLOGIQUES
05.1 Propriétés pharmacodynamiques
Classe pharmacothérapeutique : céphalosporines de première génération, code ATC : J01DB04.
Activité antibactérienne. La céfazoline agit en inhibant la synthèse de la paroi cellulaire bactérienne. Son action bactéricide s'exerce sur de nombreux germes Gram positif et Gram négatif, notamment : Staphylococcus aureus (penicilino-sensible et penicilino-résistant), Streptocoque viridans,Streptocoque pyogène, Staphylocoque épiderme, Streptocoque pneumonie, Klebsiella pneumonie, Enterobacter aérogènes, Haemophilusla grippe, Neisseria gonorrhée, Escherichia coli, Protée mirabilis.
En cas d'infections des fluides corporels causées par des souches de Staphylococcus aureus sensible à la méthicilline (MSSA), la céfazoline peut être utilisée comme médicament de premier choix associé à un aminoside. Cependant, dans certaines circonstances telles que le développement d'une péritonite liée à la dialyse péritonéale, des souches de Staphylocoque MSSA peut développer la formation de biofilm en raison de la présence de la surface synthétique des cathéters utilisés pour la dialyse. Une fois le biofilm formé, les souches MSSA subissent des modifications de leur structure, ce qui nécessite des concentrations beaucoup plus élevées de l'antibiotique pour inhiber leur prolifération. Les bactéries modifiées peuvent devenir résistantes à la céfazoline et l'évaluation de leur sensibilité au médicament par les méthodes classiques de détermination de la concentration minimale inhibitrice (CMI) peut être insuffisante pour une estimation correcte de la concentration réelle d'antibiotique utile pour inhiber le biofilm . Dans ce cas, la détermination de la concentration minimale d'éradication du biofilm (MBEC) doit être effectuée dans des laboratoires expérimentés dans la mise en œuvre de cette technique in vitro.
La céfazoline est éliminée principalement par le rein et, lorsqu'elle est administrée en concomitance avec le probénécide, ce dernier réduit son élimination car il entre en compétition pour l'excrétion tubulaire rénale.Cet effet peut être utilisé avec profit dans certains cas pour augmenter les concentrations de céfazoline dans le sérum.
05.2 Propriétés pharmacocinétiques
Administrée par voie parentérale à l'homme, la céfazoline atteint rapidement des concentrations sanguines maximales et est maintenue à des concentrations utiles pendant 8 à 12 heures. La liaison aux protéines plasmatiques est de 60 à 80 %. La céfazoline est détectable à des concentrations efficaces dans de nombreux tissus et organes tels que les poumons, les amygdales, paroi de la vésicule biliaire, appendice.
La céfazoline atteint des taux élevés (environ la moitié des taux sanguins) dans la bile et le liquide synovial. Dans une étude pharmacocinétique menée par perfusion intraveineuse continue chez 7 patients adultes, le pourcentage de la fraction libre dans le liquide interstitiel (17,5%) était similaire au pourcentage de la fraction libre dans le plasma non liée aux protéines sériques (26,6%). la mesure a lieu à régime permanent. Dans l'étude, le rapport concentration libre interstitielle/concentration plasmatique libre était de 0,84.
La céfazoline, par contre, diffuse mal dans la liqueur et de façon négligeable dans le lait. Sa demi-vie biologique est de 1,8 à 2 heures et l'élimination est majoritairement urinaire, atteignant 70 à 80 % de la dose à 24 heures. Les concentrations urinaires maximales d'antibiotique sont de l'ordre de 2400 mcg/ml et 4000 mcg/ml respectivement après l'injection im de 500 mg et 1 g.
Chez les patients sous dialyse péritonéale (par exemple dialyse péritonéale continue ambulatoire ou dialyse péritonéale cyclique continue), la pharmacocinétique de Cefamezin est fortement influencée par le débit du dialysat. L'augmentation du débit de dialysat à > 5,50 mL/minute chez les patients sous dialyse péritonéale entraîne une augmentation de la clairance corporelle totale, une diminution de la demi-vie d'élimination plasmatique et une diminution de la demi-vie d'élimination péritonéale de Cefamezin. doit être reconsidéré pour éviter les situations de sous-dosage et les échecs thérapeutiques ultérieurs.En outre, chez les patients présentant une péritonite secondaire à une dialyse péritonéale, le débit de dialysat doit être maintenu aux valeurs antibiotiques avec Cefamezin (voir rubrique 4.4).
05.3 Données de sécurité précliniques
Les données de toxicité aiguë, étudiées chez diverses espèces animales et par différentes voies d'administration, indiquent que la céfamézine est dépourvue d'effet toxique aux doses thérapeutiques. Avec une administration orale et intraveineuse prolongée à des rats et des chiens, le médicament a été bien toléré à toutes les doses et n'a pas provoqué d'altérations dans les divers organes. De plus, la céfamézine n'a pas induit d'effets embryotoxiques et tératogènes.
06.0 INFORMATIONS PHARMACEUTIQUES
06.1 Excipients
Chaque ampoule de solvant pour administration intramusculaire contient:
Chlorhydrate de lidocaïne, eau pour préparations injectables;
Chaque flacon de solvant pour administration intraveineuse contient:
Eau pour préparations injectables
06.2 Incompatibilité
Une incompatibilité physico-chimique a été trouvée avec les anti-inflammatoires non stéroïdiens appartenant au groupe des dérivés de l'acide phényl-propionique.
06.3 Durée de validité
En emballage intact : 24 mois
Après reconstitution du produit : après préparation extemporanée, la solution est stable 24 heures à température ambiante et 96 heures si conservée au réfrigérateur (5°C).
06.4 Précautions particulières de conservation
Le produit doit être conservé dans la boîte en carton jusqu'à utilisation.
Dans les solutions un dépôt cristallin peut se former : pour récupérer la solution limpide, chauffer le flacon dans le creux de la main ou dans de l'eau tiède.
06.5 Nature du conditionnement primaire et contenu de l'emballage
Flacon en verre avec bouchon en caoutchouc/aluminium contenant de la céfazoline et flacon en verre contenant du solvant.
1 flacon de 250 mg + 1 flacon de solvant de 2 ml
1 flacon de 500 mg + 1 flacon de 2 ml de solvant
1 flacon de 1000 mg + 1 flacon de solvant de 4 ml
VOIE INTRAMUSCULAIRE
1 flacon de 1000 mg + flacon de solvant de 10 ml
VIA ENDOVENOSA
06.6 Instructions d'utilisation et de manipulation
Rien
07.0 TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHE
PFIZER ITALIA S.r.l.
Via Isonzo, 71 - 04100 Latina
08.0 NUMÉRO D'AUTORISATION DE MISE SUR LE MARCHÉ
CEFAMEZIN 250 mg/2 ml poudre et solvant pour solution injectable pour voie intramusculaire,
1 flacon de 250 mg + 1 flacon de solvant de 2 ml - A.I.C. 022662098
CEFAMEZIN 500 mg/2 ml poudre et solvant pour solution injectable pour voie intramusculaire,
1 flacon de 500 mg + 1 flacon de solvant de 2 ml - A.I.C. 022662062
CEFAMEZIN 1000 mg/4 ml poudre et solvant pour solution injectable pour voie intramusculaire,
1 flacon de 1000 mg + 1 flacon de solvant de 4 ml - A.I.C. 022662011
CEFAMEZIN 1000 mg/10 ml poudre et solvant pour solution injectable pour voie intraveineuse,
1 flacon de 1000 mg + 1 flacon de solvant de 10 ml - A.I.C. 022662124
09.0 DATE DE PREMIÈRE AUTORISATION OU DE RENOUVELLEMENT DE L'AUTORISATION
Date de première autorisation : 29 novembre 1972
Date du plus récent renouvellement : 31 mai 2010
10.0 DATE DE RÉVISION DU TEXTE
Résolution AIFA du 16 septembre 2013