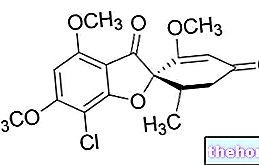
Qu'est-ce que Cerdelga - eliglustat et dans quel cas est-il utilisé ?
Cerdelga est un médicament indiqué dans le traitement au long cours des patients adultes atteints de la maladie de Gaucher de type 1. La maladie de Gaucher est une maladie héréditaire rare dans laquelle on observe un déficit en une enzyme appelée glucocérébrosidase (également appelée acide bêta-glucosidase). des conditions normales métabolise une graisse appelée glucosylcéramide (ou glucocérébroside). En l'absence de l'enzyme, la graisse se dépose dans le corps, généralement dans le foie, la rate et les os. Les symptômes typiques de la maladie en résultent : anémie (faible nombre de globules rouges), fatigue, tendance aux ecchymoses et aux saignements, hypertrophie de la rate et du foie, douleurs osseuses et fractures. Cerdelga est utilisé chez les patients atteints de la maladie de Gaucher de type 1, qui est la forme qui affecte normalement le foie, la rate et les os. Il est utilisé chez les personnes qui le métabolisent à une vitesse normale (c'est-à-dire chez les métaboliseurs dits « intermédiaires » ou « extensifs ») ou à une vitesse plus lente (« métaboliseurs lents »). En raison du faible nombre de patients atteints de la maladie de Gaucher, la maladie est considérée comme « rare » et Cerdelga a été désignée « médicament orphelin » (médicament utilisé dans les maladies rares) le 4 décembre 2007. Cerdelga contient le principe actif éliglustat.
Comment utiliser Cerdelga - eliglustat ?
Cerdelga est disponible sous forme de gélules (84 mg) à prendre par voie orale. Le médicament n'est délivré que sur ordonnance et le traitement doit être instauré et supervisé par un médecin expérimenté dans la prise en charge de la maladie de Gaucher. Avant de commencer le traitement par Cerdelga, un test doit être effectué pour déterminer la rapidité avec laquelle le médicament est métabolisé dans l'organisme des patients (c'est-à-dire pour déterminer s'ils sont des métaboliseurs lents, intermédiaires ou importants).Le médicament ne doit pas être administré aux patients qui le métabolisent. à un taux très élevé (appelés "métaboliseurs ultra-rapides") ou aux personnes dont la capacité à métaboliser le médicament n'est pas connue ou chez qui le taux de métabolisme n'a pas été déterminé dans un test spécifique. La dose recommandée de Cerdelga est d'une gélule deux fois par jour chez les patients ayant une « activité métabolique dans la plage normale » (métaboliseurs intermédiaires ou extensifs). Chez les patients dont l'organisme métabolise le médicament lentement (métaboliseurs lents), la dose recommandée est d'une gélule une fois par jour. Pour plus d'informations, consultez la notice.
Comment fonctionne Cerdelga - eliglustat ?
Le principe actif de Cerdelga, l'éliglustat, agit en bloquant l'action d'une enzyme impliquée dans la production de glucosylcéramide, car l'accumulation de cette substance grasse dans des organes tels que la rate, le foie et les os est responsable des symptômes de la maladie de Gaucher de type 1. , réduire sa production permet de limiter son accumulation dans ces organes, qui fonctionnent donc mieux.
Quel bénéfice Cerdelga - eliglustat a-t-il montré au cours des études ?
Cerdelga s'est avéré efficace dans le traitement de la maladie de Gaucher dans deux études principales. Dans la première étude, qui portait principalement sur la réduction de la taille de la rate, 40 patients atteints de la maladie de Gaucher de type 1 non traités auparavant ont participé. une réduction moyenne de la taille de la rate de 28 % par rapport à l'augmentation de 2 % observée chez les patients traités par placebo (un traitement fictif) neuf mois après le traitement. Les patients traités par Cerdelga ont également montré une amélioration d'autres signes de la maladie, notamment une réduction de la taille du foie et une augmentation des taux d'hémoglobine (la protéine des globules rouges qui transporte l'oxygène dans le corps). L'efficacité de Cerdelga a également été démontrée dans une autre étude portant sur 160 patients atteints de la maladie de Gaucher de type 1 qui avaient été précédemment traités par un traitement enzymatique substitutif absent et dont les symptômes de la maladie étaient sous-jacents. Certains patients ont été traités par Cerdelga, tandis que d'autres ont été traités par un traitement enzymatique substitutif. Cette étude a révélé qu'après un an de traitement, la maladie restait stable chez 85 % des sujets traités par Cerdelga comparativement à 94 % des patients qui ont poursuivi le traitement enzymatique substitutif.
Quel est le risque associé à Cerdelga - éliglustat ?
L'effet indésirable le plus courant avec Cerdelga (pouvant affecter plus d'une personne sur 10) est la diarrhée, qui affecte environ 6 patients sur 100. La plupart des effets indésirables sont légers et transitoires. Pour la liste complète des effets indésirables détectés avec Cerdelga, voir l'emballage brochure. Cerdelga ne doit pas être pris en association avec certains médicaments qui peuvent interférer avec la capacité de l'organisme à le décomposer, car cette interférence peut affecter les taux sanguins de Cerdelga.Pour la liste complète des restrictions, voir la notice.
Pourquoi Cerdelga - eliglustat a-t-il été agréé ?
Le comité des médicaments à usage humain (CHMP) de l'Agence a décidé que les bénéfices de Cerdelga sont supérieurs à ses risques et a recommandé que son utilisation soit approuvée dans l'UE. Cerdelga s'est avéré efficace pour améliorer les symptômes de la maladie. majorité des patients atteints de la maladie de Gaucher de type 1 non traités auparavant, ainsi que dans le maintien d'une maladie stable chez la plupart des patients précédemment traités par une enzymothérapie substitutive.Cependant, une minorité de patients (environ 15 %) qui sont des patients qui sont passés de la thérapie enzymatique substitutive à Cerdelga n'ont pas répondu de manière optimale après un an de traitement. D'autres options de traitement doivent être envisagées pour ces patients. La progression de la maladie doit être surveillée périodiquement chez tous les patients qui abandonnent le traitement. Enzyme de remplacement de Cerdelga En ce qui concerne la sécurité, bien que les effets secondaires aient été de principalement de nature légère et transitoire, le CHMP a recommandé d'étudier plus avant la sécurité à long terme du médicament.
Quelles mesures sont prises pour garantir une utilisation sûre et efficace de Cerdelga - eliglustat ?
Un plan de gestion des risques a été élaboré pour garantir que Cerdelga est utilisé de la manière la plus sûre possible. Sur la base de ce plan, des informations de sécurité ont été ajoutées au résumé des caractéristiques du produit et à la notice de Cerdelga, y compris les précautions appropriées à suivre par les professionnels de santé et les patients. En outre, la société qui commercialise Cerdelga fournira aux médecins et aux patients du matériel pédagogique pour garantir que seules les personnes atteintes de la maladie de Gaucher de type 1 sont traitées avec Cerdelga et que le médicament n'est pas utilisé en association avec d'autres médicaments susceptibles d'altérer considérablement leur taux sanguin. Tous les patients auxquels Cerdelga a été prescrit recevront une carte d'alerte. La société tiendra également un registre des patients traités par Cerdelga pour évaluer la sécurité à long terme du médicament. De plus amples informations sont disponibles dans le résumé du plan de gestion des risques.
Plus d'informations sur Cerdelga - eliglustat
Le 19 janvier 2015, la Commission européenne a accordé à Cerdelga une "Autorisation de mise sur le marché" valable dans toute l'Union européenne. Pour plus d'informations sur la thérapie Cerdelga, consultez la notice (jointe à l'EPAR) ou consultez votre médecin ou votre pharmacien. Le résumé de l'avis du comité des médicaments orphelins pour Cerdelga est disponible sur le site internet de l'Agence : ema.Europa.eu/Find medicine / Human Medicines / Rare disease design.Dernière mise à jour de ce résumé : 01-2015.
Les informations sur Cerdelga - eliglustat publiées sur cette page peuvent être obsolètes ou incomplètes. Pour une utilisation correcte de ces informations, consultez la page Avis de non-responsabilité et informations utiles.