Edité par le Dr Lorenzo Boscariol
" première partie
Réparation en première intention
La première phase est celle de "l'hémostase". Immédiatement après une lésion tissulaire, une vasoconstriction artérielle transitoire se produit en grande partie en raison d'un réflexe vasoconstricteur neurogène, mais aussi en partie à la libération locale d'endothéline. Vient ensuite l'activation plaquettaire (parfois aussi appelée hémostase primaire), puis la véritable phase de coagulation qui conduit à la formation du caillot de fibrine (hémostase secondaire).
Les plaquettes sont des éléments circulants hautement réactifs. Le facteur le plus important pour empêcher leur activation est l'intégrité structurelle et fonctionnelle de l'endothélium. Cependant, suite à un traumatisme, la lésion de l'endothélium découvre la matrice sous-endothéliale extracellulaire (matrice extracellulaire, MEC) qui déclenche l'adhésion plaquettaire et les phénomènes suivants (activation, agrégation, sécrétion). De plus, l'activation de la cascade de coagulation (voir ci-dessous) conduit à la production de thrombine, qui est un facteur soluble supplémentaire dans l'activation des plaquettes.Même la simple adhésion au collagène sous-endothélial, en l'absence de facteurs solubles de stimulation, est un facteur très puissant de activation plaquettaire.
Après l'activation, les plaquettes subissent la réaction de libération (sécrétion) qui conduit à la libération de médiateurs préformés qui améliorent encore l'agrégation et la formation du caillot. Parmi ceux-ci, le plus puissant est l'adénosine diphosphate (ADP) qui s'accumule à l'intérieur des granules denses. De plus, la synthèse d'agents vasoconstricteurs à activité agrégante, comme le thromboxane A2 (TXA2), est déclenchée. Dans l'hémostase, la déformation des plaquettes (changement de forme) est également très importante, conduisant à la fusion des éléments individuels en une masse visqueuse amorphe qui stabilise davantage le coagulum primaire.L'adhésion, l'agrégation et l'activation des plaquettes sont inextricablement liées à la véritable coagulation. cascade. En effet, la formation du caillot à la suite de lésions vasculaires est due non seulement à la stimulation des composantes intrinsèques et extrinsèques de la coagulation, mais aussi à l'exposition sur la membrane des plaquettes de phospholipides à activité pro-coagulante. Le point final de ce processus est la production et la stabilisation du caillot afin d'obstruer la lésion vasculaire et d'empêcher le sang de s'échapper.
Parallèlement à la phase plaquettaire, les voies intrinsèques et extrinsèques de la coagulation sont également activées. La voie intrinsèque est déclenchée par l'activation du facteur XII (facteur Hageman) au contact du collagène sous-endothélial, tandis que la voie extrinsèque est déclenchée par la thromboplastine tissulaire (facteur tissulaire) libérée des tissus lésés.Ce facteur est constitutivement présent sur la cellule membrane. d'origine histologique différente (fibroblastes, cellules musculaires lisses, trophoblaste placentaire) ou peut être produite sous stimulus par les cellules endothéliales et les phagocytes mononucléaires. La thromboplastine n'est pas exclusivement libérée suite à la lyse cellulaire, mais peut également être libérée suite à la stimulation de la membrane du TLR famille (Toll-Like Receptors) (par exemple au cours d'une septicémie).Dans ce cas, la thromboplastine est transportée dans le milieu péricellulaire par des vésicules lipidiques particulières appelées microparticules de diamètre compris entre 200 nm et 1 mm (microparticules) qui permettent d'en concentrer de grandes quantités dans un espace très restreint, et donc d'en renforcer les effets.
La cascade de la coagulation culmine avec la dégradation du fibrinogène en fibrine, dont le réseau polymérique piège alors les éléments figurés du sang formant ainsi le caillot typique. Pour souligner davantage l'interaction étroite entre les plaquettes et la cascade de coagulation, le fibrinogène est également important dans l'agrégation plaquettaire.En effet, dans des conditions de repos, le récepteur du fibrinogène exprimé sur la membrane plaquettaire (une glycoprotéine membranaire appelée GpIIb-IIIa), a une très faible affinité pour le fibrinogène lui-même, et est incapable de le lier.Cependant, en présence d'ADP (sécrété par les plaquettes elles-mêmes) ce récepteur subit un changement de conformation qui augmente son affinité et lui permet de se lier efficacement au fibrinogène. De cette manière, il est possible de former une liaison solide entre des plaquettes adjacentes et de stabiliser leur interaction.
Le caillot est indispensable non seulement, évidemment pour l'hémostase immédiate, mais aussi pour la réparation ultérieure de la lésion, en fait les leucocytes piégés à l'intérieur, et activés suite à l'adhésion avec le réseau de fibrine et avec les autres cellules adjacentes, ils libèrent précocement et tardivement. médiateurs de l'inflammation. Ces médiateurs, ainsi que les produits de dégradation de la fibrine, exercent une puissante action chimiotactique sur les leucocytes du sang et ceux résidant dans l'interstitium tissulaire, ainsi que des facteurs de croissance et de différenciation essentiels pour les phases ultérieures de l'angiogenèse et de la reconstitution de l'intégrité tissulaire.
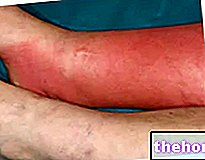
Le caillot obstrue la lésion et arrête rapidement le saignement.La surface exposée à l'air se déshydrate et se durcit, augmentant ainsi la résistance aux traumatismes externes. Dans les premières heures, les bords de la plaie sont infiltrés par des neutrophiles qui forment un agrégat cellulaire dense surtout à la périphérie du caillot. Dans les 24 à 48 heures l'infiltrat de cellules polymorphonucléaires est progressivement remplacé par des macrophages et en même temps la prolifération et la différenciation des cellules conjonctives (fibroblastes et myofibroblastes), des cellules endothéliales et de l'épithélium de revêtement commencent. la réépithélialisation de la plaie. Dans les 72 heures, la substitution des cellules polymorphonucléaires par des macrophages est presque complète et la formation du tissu de granulation commence. Dans le même temps, l'activation des fibroblastes aux bords de la plaie conduit à la dépôt de fibrilles de collagène, principalement disposées parallèlement à l'incision, et donc pas encore en mesure de rétablir la continuité tissulaire à travers la lésion.
La formation de tissu de granulation se poursuit pendant les cinq à six premiers jours suivant le traumatisme, puis, au début de la deuxième semaine, elle diminue pour être remplacée par le dépôt de tissu de collagène.La régression du tissu de granulation s'accompagne de la disparition des vaisseaux nouvellement formés qui sont un composant essentiel. Lors d'un examen externe, la régression du tissu de granulation est signalée par le "blanchiment de la plaie. En 4 à 5 semaines, la cicatrisation est terminée, avec la disparition presque complète de l'infiltrat inflammatoire , la perfection de la réépithélialisation , et l'organisation des fibrilles conjonctives dans un sens transversal, de manière à reconstituer une continuité tissulaire stable à travers la lésion. Le processus de maturation du tissu cicatriciel se poursuit cependant pendant au moins 2-3 mois ( voir ci-dessous). Les phanères ne se régénèrent pas, et en fait toutes les cicatrices (chez l'homme mais pas par exemple chez le lapin) sont exemptes de les cheveux et les glandes sudoripares. De plus, compte tenu de la faible capacité de régénération des mélanocytes, les cicatrices sont souvent hypopigmentées.
Plus d'articles sur "Cicatrisant des plaies - Réparation d'intention primaire"
- Guérison des plaies
- Cicatrisation - Evolution du processus réparateur
- Cicatrisation - phase cicatricielle