Les protéines
Les protéines sont des molécules polymères composées de plus de 100 acides aminés liés par des liaisons peptidiques (les chaînes d'acides aminés plus courtes sont appelées polypeptides ou peptides); la structure des protéines peut être plus ou moins longue, repliée sur elle-même et fixée sur d'autres molécules (facteurs qui déterminent leur complexité et caractérisent leur fonction biologique). Ces structures peuvent être classées en : structure primaire, structure secondaire (hélice α et feuille ), structure tertiaire et structure quaternaire.


Fonctions des protéines
Dans la nature, les protéines remplissent de nombreuses fonctions et la plus connue est sans aucun doute la fonction structurelle ; il suffit de penser que chaque matrice tissulaire de notre organisme est basée sur un squelette ou une mosaïque polymérique formée de peptides (par exemple, fibres musculaires, matrice osseuse, tissu conjonctif et, d'un certain point de vue, même du sang).
Non moins importante est la fonction de biorégulation et de médiation chimique/hormonale, en fait les protéines sont les constituants de base des enzymes et de nombreuses hormones.
Dans le sang, les protéines remplissent également une fonction de transport très importante ; c'est le cas de l'hémoglobine (transport de l'oxygène), de la transferrine (transport du fer), de l'albumine (transport des molécules lipidiques), etc.
Toujours à l'intérieur de la circulation sanguine, les protéines s'avèrent utiles comme défense immunitaire, elles constituent les ANTICORPS, molécules essentielles produites par les lymphocytes utiles dans la réponse de l'organisme contre les agents pathogènes.
Enfin, les protéines - mais plus précisément les acides aminés - peuvent être utilisées à des fins énergétiques grâce à la néoglucogenèse hépatique et apporter 4 kilocalories (kcal) par gramme. C'est un processus assez compliqué qui, par transamination et désamination, permet à l'organisme de produire du glucose dans des conditions hypoglycémiques (éventuellement induites par le jeûne, un effort musculaire particulièrement intense et/ou prolongé, des conditions pathologiques ou cliniques défavorables, etc.). peuvent également être cétogènes, leur conversion détermine donc la libération de molécules acides appelées corps cétoniques.
NB. La fonction énergétique des protéines doit être marginale et subordonnée à celle des sucres et des graisses.
Les acides aminés
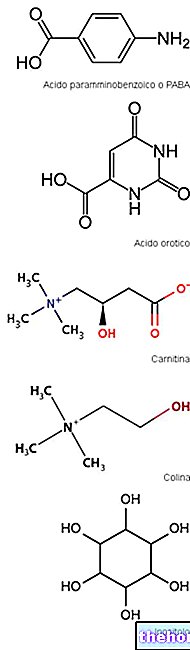
Les acides aminés sont des molécules quaternaires composées de carbone, d'hydrogène, d'oxygène et d'azote. Plus de 500 types sont connus et leur combinaison différencie d'innombrables formes de peptides. Les acides aminés ordinaires, les L-aminoacides, sont au nombre de 20 : acide aspartique, alanine, arginine, asparagine, cystéine, acide glutamique, glutamine, glycine, histidine, isoleucine, leucine, lysine, méthionine, phénylalanine, proline, sérine, thréonine, tryptophane, tyrosine et valine. A partir du métabolisme de ces derniers, il est possible d'obtenir une large gamme d'acides aminés NON ordinaires ou occasionnels qui constituent principalement des hormones, des enzymes ou des molécules intermédiaires (carnitine, homocystéine, créatine, taurine, etc.).
Parmi les acides aminés ordinaires, certains NE PEUVENT PAS être synthétisés par l'organisme et sont appelés ESSENTIELS ; pour l'homme adulte il y en a 9 : phénylalanine, leucine, isoleucine, lysine, méthionine, thréonine, tryptophane et valine. Chez les enfants, il y en a 11 en tout ; à ce qui précède s'ajoutent : histidine et arginine.
D'autres classifications des acides aminés sont : basées sur la polarité de leurs chaînes latérales (neutre apolaire, neutre polaire, charge acide, charge basique) ou basée sur le type de groupe radical (hydrophobe, hydrophile, acide, basique, aromatique).
Acides aminés à chaîne ramifiée
Parmi les essentiels, il y a aussi trois acides aminés appelés respectivement chaîne ramifiée (BCAA) : leucine, isoleucine et valine; la particularité qui distingue les acides aminés à chaîne ramifiée des autres est représentée par une voie métabolique différente de production d'énergie.
Comme déjà expliqué, après transamination-désamination, la plupart des acides aminés peuvent être destinés à la néoglucogenèse et entrer dans le cycle de Krebs sous forme de oxaloacétate tu détestes pyruvate. A terme, s'il y avait un réel besoin, certains des acides aminés présents dans le sang entreraient dans les hépatocytes du foie et sortiraient sous forme de glucose ; pour les acides aminés à chaîne ramifiée, ce n'est pas le cas. Par rapport aux autres, les BCAA sont des molécules utilisables DIRECTEMENT par les muscles, et cette particularité les rend beaucoup plus efficaces en production directe d'énergie et en conversion pour la reconstitution des réserves de glycogène ; il va de soi que, si l'organisme est suffisamment nourri, le catabolisme des acides aminés ramifiés représente une portion néoglucogénique presque sans importance ; le glucose reste TOUJOURS la principale source d'énergie, par conséquent, dans des conditions de réserves de glycémie et de glycogène SUFFISANTES, même lors d'une performance sportive ordinaire, il n'y a aucune raison de craindre que le muscle ait besoin d'un surplus d'acides aminés à chaîne ramifiée.
Autres articles sur "Protéines et acides aminés à chaîne ramifiée"
- Acides aminés ramifiés : quand les prendre ?
- Protéines alimentaires
- Décomposition des protéines - Quand le prendre ?