Edité par le Dr Lorenzo Boscariol
" Partie trois
Le tissu de granulation
Le tissu de granulation, qui provient des bords de la plaie et est constitué de fibroblastes, de myofibroblastes, de cellules inflammatoires, de MEC et surtout de vaselines nouvellement formées, est ainsi défini pour l'aspect granuleux donné à sa surface précisément par la riche texture des vaisseaux vasculaires nouvellement formés. La richesse du composant vasculaire et les fortes concentrations de médiateurs vasoactifs provoquent la formation dans le tissu de granulation d'un riche exsudat inflammatoire, ce qui le rend fortement œdémateux.Dans la formation du tissu de granulation, et plus généralement dans le processus de cicatrisation, un La phase cruciale est constituée par "l'angiogenèse". Par angiogenèse, nous entendons ce processus par lequel les vaisseaux préexistants produisent des vases nouvellement formés par bourgeonnement. L'angiogenèse est un processus fondamental non seulement dans la réparation des plaies, mais aussi dans l'inflammation chronique, la réponse tissulaire à l'hypoxie et à la croissance tumorale, et le mécanisme en jeu est toujours fondamentalement le même.Schéma, l'angiogenèse passe par les phases suivantes : 1) production d'un stimulus angiogénique; 2) digestion protéolytique de la membrane basale des vaisseaux voisins pour permettre le bourgeonnement et la migration des cellules endothéliales dans l'interstitium cellulaire ; 3) prolifération des cellules endothéliales le long de la nouvelle voie de migration avec formation de jetons endothéliaux solides ; 4) inhibition de la prolifération et de l'induction de différenciation des jetons cellulaires solides dans les tubes capillaires ; 5) recrutement et différenciation des cellules périendothéliales.
Bien que divers facteurs de croissance puissent exercer une action angiogénétique plus ou moins pertinente, il ne fait aucun doute que le facteur le plus important, au moins à l'âge adulte, est le facteur de croissance de l'endothélium vasculaire (VEGF). Le VEGF est produit par pratiquement toutes les cellules dans des conditions hypoxiques, et en fait nous savons que la réponse angiogénique est l'une des premières réponses locales à la privation d'oxygène. Cependant, le gène végétarien il ne répond pas directement à l'hypoxie, mais sa transcription est stimulée par un facteur supplémentaire appelé facteur 1 induit par l'hypoxie (HIF-1). Cela soulève un paradoxe intéressant : les plaies ne sont généralement pas hypoxiques, alors comment peut-on induire HIF-1, et par conséquent VEGF, dans ces conditions ? La solution au problème réside probablement encore dans la composante inflammatoire de la régénération, puisque d'une part la transcription de HIF-1 peut également être stimulée par l'IL-1 et le TNF-a, et d'autre part l'expression du VEGF peut être directement induite par des espèces radicalaires (espèces activées par l'oxygène) produites par des cellules inflammatoires.
l'angiogenèse devant nécessairement être un processus coordonné, des facteurs ayant une activité inhibitrice sur la motilité et la prolifération et ayant une action différenciatrice sont également sécrétés. processus qui reconstitue un réseau vasculaire tridimensionnel, et est donc également contrôlé par l'interaction entre les cellules endothéliales et la MEC. En particulier, les intégrines (en particulier avb3) jouent un rôle important dans la détermination de la polarité de croissance et de stabilisation des vases nouvellement formés.
A partir de la deuxième semaine, le tissu de granulation se résorbe progressivement, le réseau vasculaire disparaît et le dépôt de tissu collagène augmente. Au cours de la transition du tissu de granulation à la cicatrice fibreuse, il se produit un profond remodelage tissulaire déterminé par l'élimination contrôlée de certains tissus (par exemple l'endothélium vasculaire ou le collagène de type III) et le dépôt d'autres tissus tels que le collagène de type I. ce processus est joué par MMPs et diverses cytokines, dont le TGF-b qui stimule la synthèse non seulement de collagène mais aussi d'inhibiteurs de protéase.
La phase cicatricielle
La réparation des plaies chez l'adulte et dans les tissus fœtaux présente une différence remarquable : chez l'adulte le processus est essentiellement réparateur, ce qui est inévitablement associé à la formation d'une cicatrice fibreuse, tandis que chez le fœtus le processus est régénératif, c'est-à-dire pas accompagné d'une cicatrice fibreuse ou d'une contraction de la plaie. Le facteur discriminant semble être la présence de la réaction inflammatoire dans la cicatrisation chez l'adulte et son absence chez le fœtus.En effet, il peut être démontré expérimentalement que l'induction d'une réponse inflammatoire locale lors de la cicatrisation chez le fœtus provoque la formation de cicatrice fibreuse, et vice versa, l'application d'anticorps neutralisants contre certains facteurs de croissance tels que le TGF-b et le PDGF lors de la réparation chez l'adulte réduit la formation de cicatrice. Ces observations ont des implications évidentes pour la gestion des plaies.
Dans la phase de remplacement du tissu de granulation, les fibroblastes dont la migration a été facilitée par l'exsudation des protéines plasmatiques à travers la paroi des vaisseaux nouvellement formés, prolifèrent et déposent des quantités toujours plus importantes de collagène.En une ou deux semaines le tissu de granulation est transformée en cicatrice constituée de fibroblastes, de fibres de collagène (surtout de type I), de fibres élastiques rares. Finalement la régression des vaisseaux est presque totale avec la transformation du tissu de granulation rose et délicat en une cicatrice fibreuse pâle.
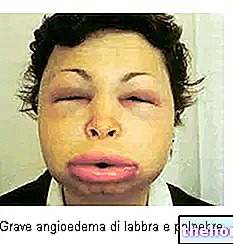
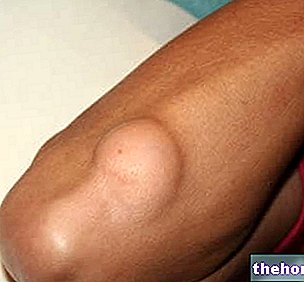
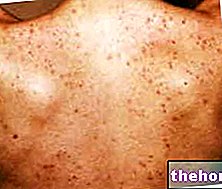
La formation de cicatrices fibreuses plus ou moins étendues est une conséquence inévitable de toute lésion tissulaire. Le tissu cicatriciel fibreux présente toujours une organisation plus désordonnée que le tissu d'origine, ce qui peut entraîner des dommages esthétiques ou fonctionnels importants, et dans le cas de lésions profondes, il peut altérer gravement la fonction viscérale (fibrose pulmonaire, cirrhose du foie, occlusion intestinale). Dans certains cas, le processus réparateur peut prendre des aspects tellement exubérants qu'il produit des cicatrices hypertrophiques et chéloïdes.En général, on parle de chéloïdes lorsque le processus cicatriciel exubérant a des caractéristiques d'irréversibilité et s'étend au-delà des marges de la lésion. Les chéloïdes sont plus fréquentes parmi les populations asiatiques et africaines, tandis que les cicatrices hypertrophiques ne semblent pas avoir une distribution ethnique ou géographique particulière. Histologiquement, on observe un riche infiltrat cellulaire dans les chéloïdes et surtout une « accumulation excessive de MEC, principalement composée de collagène de type III et d'acide hyaluronique. En effet, les fibroblastes isolés des chéloïdes synthétisent de l'acide hyaluronique beaucoup plus activement que les fibroblastes isolés de cicatrices normales. ils ont une « réponse modifiée au TGF-b. La pathogenèse des chéloïdes est inconnue, mais il est probable qu'à la base se trouve une « fonction immunitaire altérée qui, lors de la réparation de la lésion initiale, génère un microenvironnement cytokinique anormal. Par exemple, l'infiltration de lymphocytes CD4+ et de dendritiques activés. dans le derme papillaire des cicatrices hypertrophiques.
Dans certains cas, les plaies ne montrent aucune tendance à la cicatrisation spontanée. Ces lésions de cicatrisation lente ou absente donnent lieu à de véritables ulcérations. La chronicité est due à l'altération du processus normal de réparation. Cela peut être dû à la mauvaise réponse inflammatoire initiale conduisant à une production réduite de tissu de granulation et à une migration réduite des cellules épithéliales pour couvrir la plaie. Ou une contamination bactérienne persistante peut maintenir un stimulus inflammatoire aigu soutenu, de manière à empêcher l'établissement physiologique de la phase inflammatoire chronique et la phase ultérieure de remplacement du tissu de granulation par du tissu conjonctif. Histologiquement, une forte dégradation de l'ECM est observée dans les ulcères, en particulier dans le composant des glycosaminoglycanes, en particulier l'acide hyaluronique, et aussi l'activité métalloprotéique est augmentée et la concentration locale de TIMPs est réduite. Un riche infiltrat de neutrophiles et de macrophages est présent dans la peau péri-lésionnelle, tandis que la présence de cellules de Langerhans est réduite.
Facteurs affectant la guérison
De nombreux facteurs systémiques et locaux influencent la cicatrisation. L'état nutritionnel (par exemple, une carence en vitamine C qui est connue pour réduire la synthèse de collagène) ; la présence de métabolismes (par exemple le diabète sucré qui est connu pour provoquer un retard de cicatrisation) ; déficits circulatoires dus à l'athérosclérose ou à la stase veineuse ; dysendocrinies (par exemple, les hormones glucocorticoïdes ont un effet inhibiteur bien documenté sur l'inflammation et la synthèse du collagène.) Le site de la lésion est également un facteur important influençant la cicatrisation : les plaies des zones richement vascularisées ont tendance à cicatriser plus rapidement que celles des zones mal vascularisées. tout corps étranger empêche généralement la cicatrisation normale, mais la cause la plus importante de retard est certainement l'infection de la plaie.
Bibliographie de référence
1. Mouettes G Le myofibroblaste dans la cicatrisation des plaies et les maladies fibrocontractives. J Pathol 200 : 500-503.
2. Semenza GL Régulation de l'angiogenèse induite par l'hypoxie : un chaperon accompagne le VEGF jusqu'à la danse. J Clin Invest 108 : 39-40.
3. Stamenkovic I Remodelage de la matrice extracellulaire : le rôle des protéinases matricielles. J Pathol 200 : 448-464.
4. Werner S, Grose R Régulation de la cicatrisation des plaies par les facteurs de croissance et les cytokines. Physiol Rev 83 : 835-870.
5. Chanteur A.J., Clark R.A.F. Cicatrisation des plaies du coutanée. N E J Med 41 : 738-746.
6. Gallin JI, Inflammation Snyderman R. Principes de base et corrélats cliniques. Editeur Lippincott Williams & Wilkins.
7.Cotran RS, Kumar V, Collins T Robbins. Les bases pathologiques des maladies. Editeur Piccin.
Plus d'articles sur "Cicatrisant les plaies - phase cicatricielle"
- Cicatrisation - Evolution du processus réparateur
- Guérison des plaies
- Cicatrisation des plaies - Réparation d'intention primaire